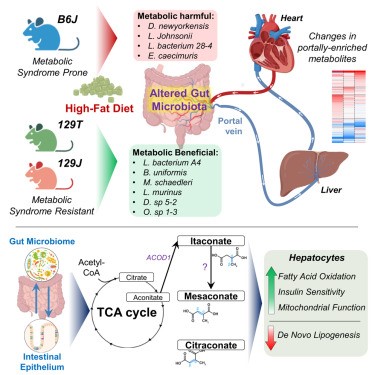
饮食和肥胖会通过肠道微生物组等途径,促进胰岛素抵抗和2型糖尿病的发生。为探究肠道代谢物在这一过程中的作用,作者评估了具有不同肥胖/糖尿病易感性的小鼠,在高脂饮食(HFD)联合抗生素处理下,其门静脉/外周血中的代谢物变化。在易患糖尿病/肥胖的C57BL/6J小鼠中,有111种代谢物在门静脉中富集,74种在外周富集,其中许多代谢物在抗代谢综合征的129S1/129S6小鼠中表现不同。万古霉素处理改变了HFD喂养的C57BL/6J小鼠的微生物组,并改变了多种代谢物的门静脉/外周比例,包括上调门静脉血中三羧酸(TCA)循环相关代谢物,如中康酸(mesaconate)。用中康酸、衣康酸(itaconate)或柠康酸(citraconate)处理分离的肝细胞,可在体外和体内改善胰岛素信号传导,并在转录水平上调节糖异生、脂肪酸氧化和脂肪生成相关基因。在人类中,柠康酸水平与血糖呈负相关。因此,门静脉与外周代谢物在微生物组影响肝脏代谢及高脂饮食相关胰岛素抵抗发病机制中发挥重要作用。 1、 门静脉血与外周血的代谢组特征存在差异。 在普通饲料喂养的动物中,门静脉血显著富集111种代谢物,心脏血富集74种(图1A)。在门静脉富集的代谢物中,73%为脂质,包括各类甘油三酯、二酰甘油和磷脂(图1B、1C)。另有6%为初级或次级胆汁酸,6%为氨基酸/N-乙酰氨基酸,4.5%为源自食物的细菌代谢物,如丁酸、色氨酸、组氨酸和维生素A代谢物(图1B、1C)。令人惊讶的是,几种门静脉富集代谢物与TCA循环(顺乌头酸、中康酸和2-羟基戊二酸)或糖异生(磷酸甘油酸/磷酸肌醇丙酮酸)相关(图1B、1C)。这些代谢物在门静脉血中的浓度高于心脏血,提示肠道微生物组、食物和/或肠道是其进入循环的主要来源。相比之下,74种代谢物在心脏(外周)血中显著富集,其中57%为脂质,包括其他种类的甘油三酯、二酰甘油、磷脂、胆固醇酯、二十二碳烷酸类和二十碳烷酸类;19%为氨基酸(甲硫氨酸、组氨酸、色氨酸和赖氨酸);13.5%为核苷或其衍生物,包括AMP、UMP、鸟苷酸(GMP)、肌苷和次黄嘌呤,后者在心脏血中富集2.7至3.4倍(图1B、1C)。心脏/门静脉比值高提示这些代谢物至少部分来源于肝脏或其他宿主组织。 图1 门静脉血代谢物对高脂饮食(HFD)呈现出独特的应答特征。 2、 门静脉代谢物富集——饮食的影响 小鼠连续 11 周摄入 60% 高脂饮食(HFD)后,其门静脉/心脏血中的代谢物组成发生显著改变。门静脉富集代谢物由 111 种锐减至 48 种(其中 31 种与普通饲料组相同),而心脏血富集代谢物则由普通饲料时的 74 种降至 HFD 时的 68 种,仍有 42 种保持不变(图 1B、1D)。门静脉富集代谢物的减少主要源于脂质类大幅减少——从 81 种降至 17 种(图 1B、1D)。在普通饲料与 HFD 之间保持门静脉富集的 31 种代谢物中,包含多条三羧酸(TCA)循环相关产物,提示它们可能来源于微生物组或肠道,而非直接来自膳食。 尽管常规饲料与高脂(HFD)喂养时心脏血富集代谢物的数量相近,仍有6种心脏富集代谢物在HFD下富集度降低,其中包括二十二碳六烯酸(DHA)、二十碳五烯酸(EPA)及20-HDoHE——均为具有抗炎活性的ω-3脂肪酸或其衍生物(图1G)。相反,促炎的ω-6衍生脂肪酸,如二十碳二烯酸、γ-亚麻酸、花生四烯酸及肾上腺酸,在两种循环中的丰度均因HFD而升高。这些促炎代谢物增多、抗炎代谢物减少的变化,可能共同加剧了HFD相关的胰岛素抵抗。 3、 肠道微生物组特征与门静脉血TCA循环代谢物的富集 前面的结果说明 HFD改变肠道代谢物向门静脉的输送,导致促炎环境 ,TCA循环产物可能来源于肠道菌群。为了验证这个可能性,作者通过抗生素干预人为改变菌群结构,万古霉素抑制革兰氏阳性菌,甲硝唑抑制厌氧菌。研究发现,两种抗生素均能改善HFD小鼠的胰岛素抵抗,门静脉中TCA代谢物上升1.5倍,胆汁酸也出现变化(图2A)。两种抗生素对代谢物谱的影响存在差异,提示不同细菌贡献的代谢物不同。 TCA中间物 (mesaconate、aconitate等) 在 门静脉 中的 富集度与某些细菌丰度 ( Akkermansia、Enterobacterales、Lactobacillales 等 ) 正相关(图2B) 。 宏基因组分析发现,这些菌群携带TCA循环酶基因表达量上升(图2D) 。这些结果表明, TCA循环代谢物确实主要来源于菌群代谢,且与特定细菌丰度相关。 抗生素干预提供了直接的因果证据:改变菌群结构可以改变门静脉血代谢物,从而改善宿主代谢。 图2 肠道菌群重构促进TCA循环代谢物在门静脉系统中的富集 4、 整合微生物组差异、抗生素效应与品系差异 作者曾报道,B6J 小鼠在高脂饮食(HFD)下会发生肥胖/胰岛素抵抗,而来自 Jackson 实验室的 129S1(129J)和来自 Taconic 的 129S6(129T)小鼠则对代谢综合征具有抵抗力(图 3A)。因此,HFD 喂养 12 周后,B6J 小鼠的体重高于两个 129 亚系(图 3B),其胰岛素抵抗/HOMA-IR 水平也更高(图 3C)。肝脏基因表达与这些代谢差异一致:两个 129 亚系肝脏中,脂肪生成转录因子 Srebp1c 及其靶基因 Acc、Fas 和 Scd1 的表达水平均低于 B6J,但糖异生基因(G6pc、Pck1 和 Fbp1)的表达无差异(图 3D)。同样,与肝脏脂肪变性和胰岛素抵抗呈负相关的 Igfbp2 在两种 129 小鼠中的表达量比 B6J 高 4 倍。 图3 C57BL/6J小鼠相较于129S6/SvEvTac(129T)和129S1/SvImJ(129J)小鼠更易发生肥胖和胰岛素抵抗 为探究肠道微生物宏基因组如何导致不同品系间的基因表达差异,作者将HFD喂养的B6J、129J和129T小鼠的微生物组进行比较(图3E),并依据其在不同品系中的丰度,把细菌划分为"代谢有益"(I类)和"代谢有害"(II类)两类。I 类细菌与体重、血糖、HOMA-IR 及肝脏脂肪生成标志物均呈显著负相关,与肝脏 Igfbp2 呈正相关,提示其可能促进胰岛素敏感性并降低体重(图 3F)。II 类微生物则与体重、血糖、HOMA-IR 及肝脏脂肪生成酶表达呈正相关,与肝脏 Igfbp2 呈负相关(图 3F),提示其可能参与胰岛素抵抗和代谢综合征的发生。 此外,在代谢物水平,在129J/129T小鼠门静脉中水平更高且富集度增加的代谢物,与更佳的代谢表型相关;而在B6J小鼠门静脉血中富集的代谢物,则与较差的代谢表型相关。这表明小鼠不同品系对HFD的抵抗力与肠道菌群的组成密切相关,其中TCA代谢物可能发挥重要作用。 5、Mesaconate(中康酸)及其异构体可调节肝脏代谢与基因表达 对高脂喂养的B6J小鼠给予抗生素(尤其是万古霉素)后,以及对胰岛素敏感性更高、代谢综合征风险更低的129J/129T品系进行的代谢组学分析显示,门静脉血中富集了多种TCA循环衍生中间产物,例如顺乌头酸和Mesaconate(中康酸)(图2A)。作者假设这些代谢物是微生物组与肝脏胰岛素作用及代谢调控之间的中介因子(图4A)。因此,作者在生理浓度范围内检测了这些代谢物对HepG2肝细胞信号传导和基因表达的影响。在 HepG2 和 AML12 肝 细胞进行体外验证,研究发现这些代谢物可以增强胰岛素信号、提高脂质氧化基因的表达、增加线粒体膜电位和氧消耗率;与之对应的是脂肪合成相关转录因子和基因表达下调。这些作用主要依赖 PPARα通路 ,而 转录抑制剂可阻断 其 作用 (图4B-G)。体内实验也证实,注射 mesaconate/itaconate 可以诱导肝脏增强脂质氧化基因的表达以及线粒体呼吸能力,抑制脂质合成。更为重要的是,在HFD小鼠中注射 mesaconate/itaconate 可以逆转胰岛素抵抗,减少肝脏中脂质的积累(图5A-H)。这些结果提示作者 Mesaconate等 TCA 代谢物在体内具有改善代谢的功能。 最后,在杰克逊心脏研究(Jackson Heart Study)——一项旨在确定非裔美国人心脏病危险因素的大型社区研究样本中,Citraconate(柠康酸)水平与空腹血糖呈显著负相关(β = −3.508,p = 0.017)(图5I),提示这些代谢物在人类体内也可能对心血管代谢健康产生有益影响。 总的来说, 这项研究发现,肠道微生物可通过产生TCA循环中间代谢物 (如mesaconate、itaconate) ,经由门静脉调控肝脏代谢和胰岛素敏感性。高脂饮食通过扰乱肠道菌群组成,改变代谢物向门静脉的输送,造成促炎环境和胰岛素抵抗,而抗生素干预可逆转这一过程。人群数据进一步证实,血液中citraconate水平与空腹血糖呈负相关,表明微生物来源代谢物具有潜在的代谢保护作用,为代谢综合征的干预提供了新方向。 图6 代谢物在门静脉血与外周血中的水平存在显著差异,且这一差异因小鼠品系、高脂饮食(HFD)和/或抗生素处理而异。三羧酸循环中间产物Mesaconate(中康酸)及其异构体是肝脏胰岛素信号传导和基因表达的强效调节因子,能够增强肝脏脂肪酸氧化并抑制新生脂肪生成。 参考文献 Vitor Rosetto Muñoz , Francois Moreau , Marion Soto, et al. Portal vein-enriched metabolites as intermediate regulators of the gut microbiome in insulin resistance. Cell Metab. 2025 Aug 29:S1550-4131(25)00361-4. doi: 10.1016/j.cmet.2025.08.005.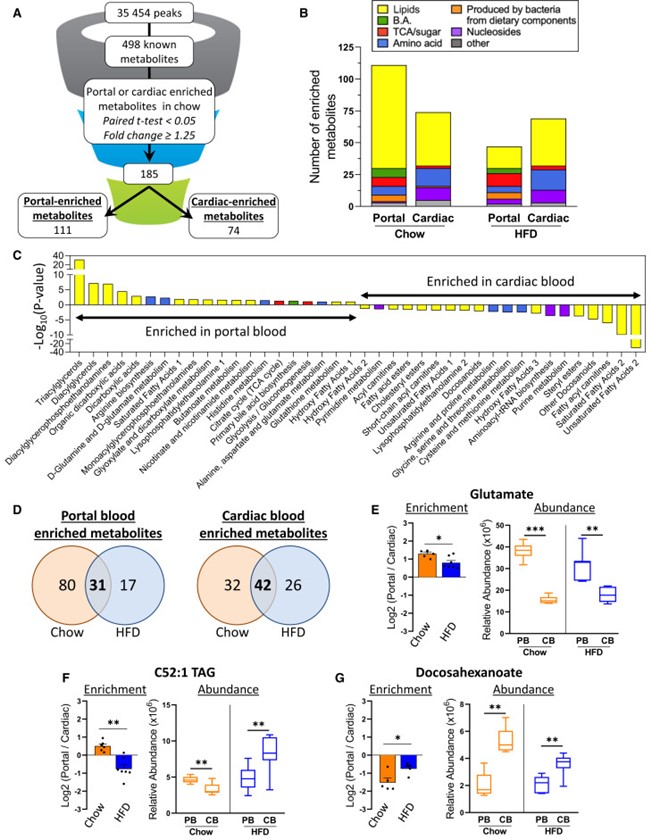
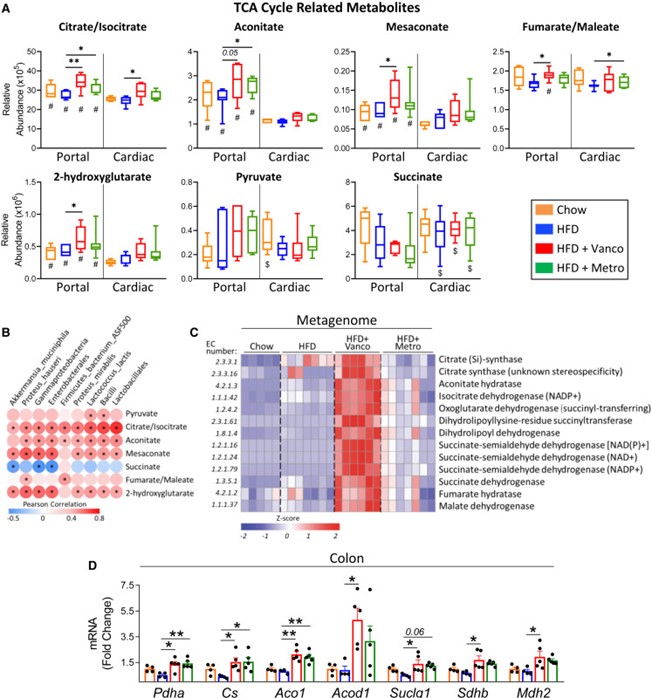
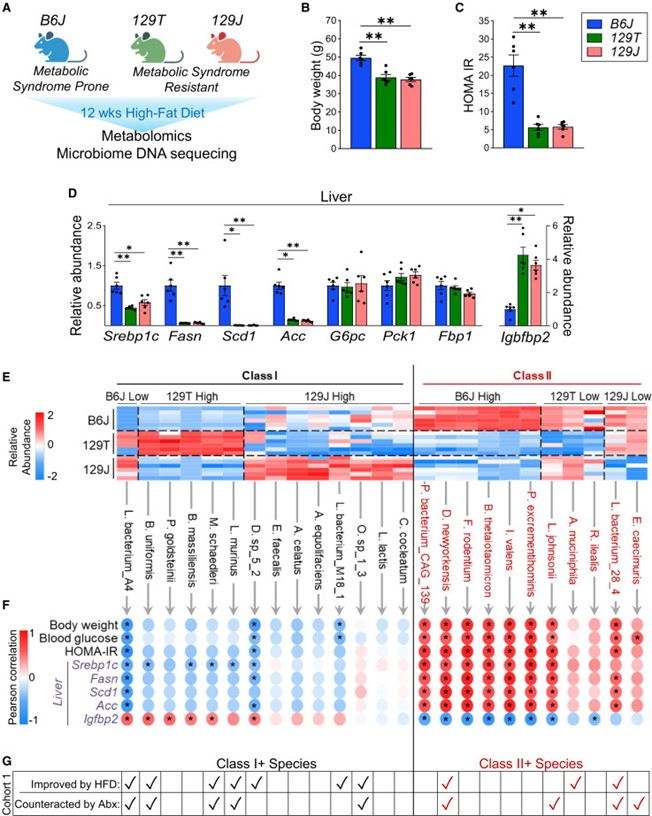
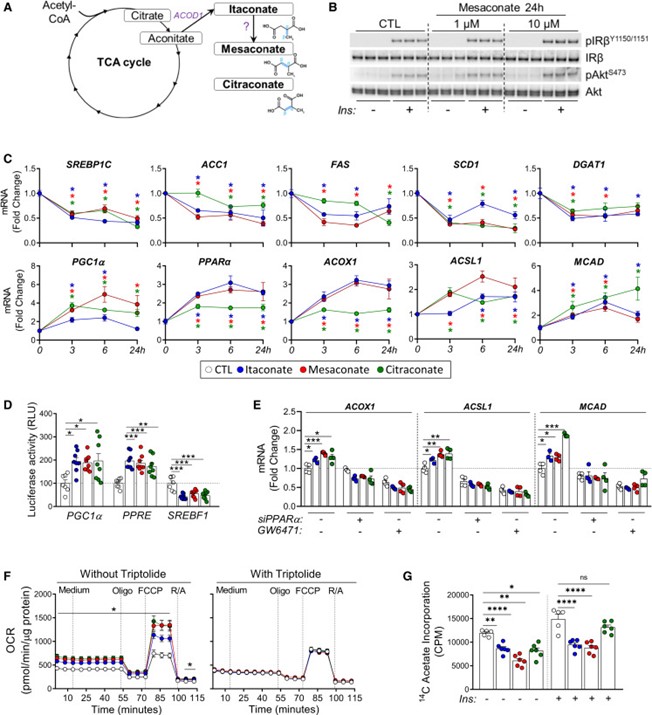
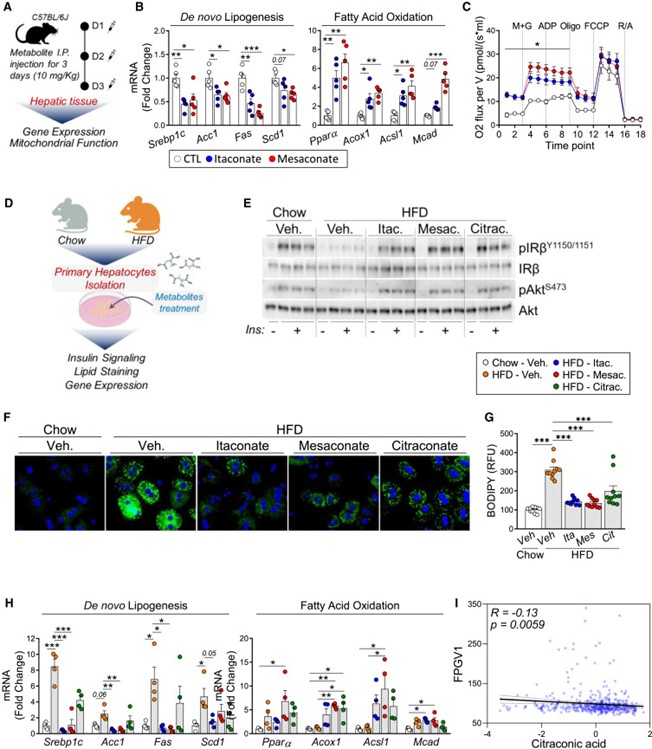
图5 Mesaconate(中康酸)及其异构体可在体内改善肝脏代谢并逆转胰岛素抵抗