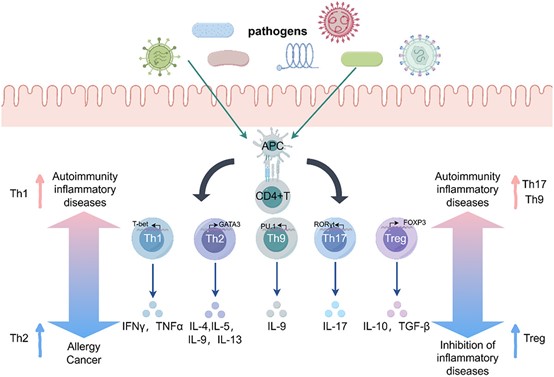
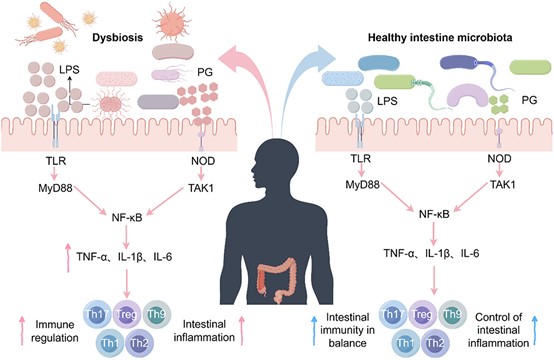
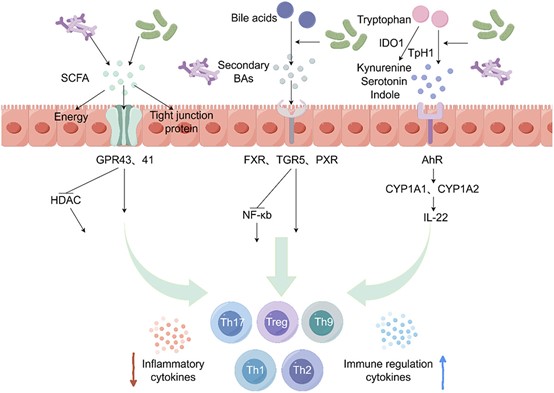
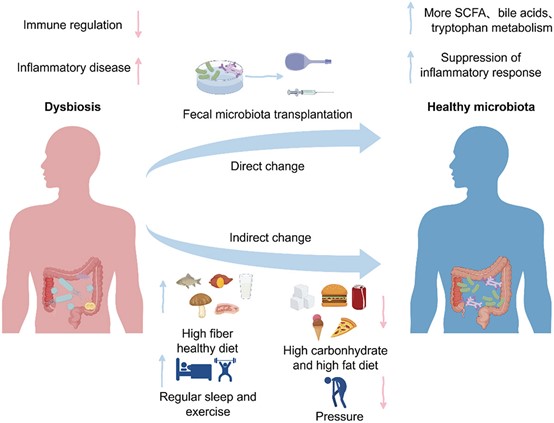
肠道炎症已成为全球重大健康挑战,是炎症性肠病(IBD)发病的核心驱动力,并带来沉重社会经济负担。肠道CD4⁺ T细胞亚群稳态失衡——尤其是促炎性Th1、Th2、Th17、Th9细胞与抗炎性调节性T细胞(Treg)之间的比例失调——是触发肠道炎症的关键环节。这些免疫细胞通过特征性细胞因子谱(IFN-γ/IL-4/IL-17/IL-9 vs. IL-10/TGF-β)精细调控免疫应答。最新研究揭示,肠道菌群通过以下三大机制主导该免疫轴:1)短链脂肪酸(SCFAs)抑制组蛋白去乙酰化酶(HDACs),诱导表观遗传重编程,促进Treg分化并抑制Th17/Th9极化;2.)次级胆汁酸(BAs)经FXR/TGR5/PXR信号通路抑制Th17定向分化;3) 色氨酸代谢产物(吲哚、犬尿氨酸)通过AhR-IL-22信号平衡Th17/Treg比例。菌群失调则通过分泌病原体相关分子模式(PAMPs,如LPS、肽聚糖)激活模式识别受体(PRRs,如TLR4/NOD2/NF-κB),驱动Th1/Th17过度分化,破坏上述网络平衡。本文系统梳理菌群-CD4⁺ T细胞互作的最新进展,并探讨靶向调控肠道菌群的潜在治疗策略,以期深化对IBD发病机制的理解,为临床干预提供新思路。 肠道炎症已成为全球性的健康难题,推动炎症性肠病(IBD)—尤其是克罗恩病(CD)和溃疡性结肠炎(UC)—患病率持续攀升,并给医疗机构带来沉重经济负担。全球每年用于IBD管理的医疗支出超过120亿美元,疾病导致的生产力损失更凸显了对创新治疗策略的迫切需求。该病理的免疫学核心在于CD4⁺ T细胞稳态失衡。初始CD4⁺ T淋巴细胞在抗原刺激下发生谱系特异性分化,形成促炎亚群:Th1/Th2/Th17/Th9等辅助T细胞;以及免疫抑制亚群:调节性T(Treg)细胞。这一精细平衡由细胞因子网络调控—促炎因子TNF-α/IL-6与抗炎因子IL-10/TGF-β的对抗。因此,寻找能有效调控这些T细胞亚群间平衡的机制,已成为肠道炎症管理的关键。 肠道菌群是一个由超过100万亿微生物组成的生态系统,编码约300万个独特基因,已被确认为宿主免疫的关键调控者。它主导着70%的肠道免疫反应,被视为人体最大的内分泌网络。其与黏膜免疫细胞的共生关系对维持肠道稳态至关重要,其失衡与80%的IBD病例及全球40%的免疫介导性疾病相关。菌群通过三类核心代谢物发挥免疫调节功能:短链脂肪酸(SCFAs)、次级胆汁酸(BAs)和色氨酸代谢产物。这一精密网络的失调会触发级联病理反应。因此,深入理解这些代谢物的作用机制,并探索通过调控菌群组成进而影响其代谢产物的策略,成为缓解肠道炎症的新方向。 因此,本文聚焦于不同T细胞亚群分化的机制及其对肠道炎症的影响,以及肠道菌群对这些免疫机制的调控作用;并进一步探讨改善肠道微生态的方法学策略。 1、 CD4⁺ T 细胞亚群失衡引发肠道炎症 炎症是先天免疫系统应对病原入侵的基本防御机制。在生理状态下,抗原提呈细胞(APC)—尤其是树突状细胞(DC)和巨噬细胞—通过模式识别受体(PRR,如Toll样受体4,TLR4)识别病原体相关分子模式(PAMP),主要启动核因子-κB(NF-κB)介导的促炎细胞因子(IL-1β、TNF-α、IL-6)级联反应。该反应继而招募吞噬细胞、自然杀伤细胞及淋巴细胞清除病原体,并通过MHC-II介导的抗原提呈启动适应性免疫。然而,这一精密系统的失调会导致慢性炎症和自身免疫病。PRR的持续激活诱导促炎信号,驱动IBD中病理性T细胞反应。IL-10分泌型Treg等负调控机制通常可限制过度炎症。CD4⁺ T淋巴细胞占人肠固有层淋巴细胞的60–70%,是该免疫病理过程的核心(图1)。 图1. 肠道CD4+ T细胞的分化与功能亚群 在肠道中,初始CD4+ T细胞经历分化过程,形成不同的效应亚型。这种分化是在抗原呈递细胞(APCs)呈递抗原的刺激下发生的。这些亚型包括表达转录因子T-bet的Th1细胞和表达GATA结合蛋白3(GATA3)的Th2细胞。Th1细胞主要分泌促炎细胞因子,如干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α),而Th2细胞产生白细胞介素IL-4、IL-5、IL-9和IL-13,当它们过度表达时,分别驱动炎症或过敏反应。此外,CD4+ T细胞还具有分化为三种不同类型细胞的能力:Th17细胞以表达视黄酸相关孤儿受体γt(RORγt)为特征,调节性T细胞(Tregs)以表达叉头框P3(Foxp3)为特征。Th17细胞分泌细胞因子IL-17,在过度激活时介导肠道炎症。相反,Tregs分泌抗炎细胞因子IL-10和转化生长因子-β(TGF-β),从而抵消促炎效应。此外,Th9细胞以表达PU.1为特征,分泌IL-9并促进炎症反应。然而,Treg细胞对Th9细胞也具有抑制作用。这些亚型之间需要精心调节的平衡以维持肠道免疫稳态;这种平衡的破坏可能导致免疫失调和疾病。 2、肠道菌群对肠道CD4+ T细胞分化具有深远影响。 图2. 肠道菌群对免疫细胞功能的调控作用。 在稳态条件下,肠道菌群来源的脂多糖(LPS)已被证实可诱导Toll样受体(TLRs)的适度激活。这些受体随后通过衔接分子髓样分化因子88(MyD88)传递信号,从而激活核因子-κB(NF-κB)通路。同样,细菌肽聚糖(PG)可激活核苷酸结合寡聚化结构域(NOD)样受体,进而激活转化生长因子-β激活激酶1(TAK1)及NF-κB通路。这些信号级联可诱导促炎细胞因子(如TNF-α、IL-1β和IL-6)的受控分泌,促进免疫发育并增强对病原体的抵抗力。相反,菌群失调已被证实会导致LPS和PG的过度产生,引发TLR/NOD受体的过度激活及持续性NF-κB信号传导。这种高度炎症环境已被证实可促进CD4+ T细胞向促炎的Th17、Th9和Th1表型分化,从而破坏免疫平衡并导致肠道炎症性疾病。 3、 微生物代谢产物对CD4+ T细胞分化的调控 图3. 介导肠道菌群代谢产物对免疫细胞作用的信号通路 肠道菌群主要通过产生代谢产物——包括短链脂肪酸(SCFA)、胆汁酸(BA)和色氨酸衍生物——来调控宿主的免疫稳态。SCFA 作为肠上皮细胞的主要能量底物,已被证实可促进上皮增殖及紧密连接蛋白表达,从而增强屏障完整性。此外,研究表明 SCFA 通过结合 G 蛋白偶联受体(GPR)并抑制组蛋白去乙酰化酶(HDAC)活性,进而促进调节性 T 细胞(Treg)分化与免疫调节。进入肠道的一级胆汁酸经细菌代谢生成二级胆汁酸,后者通过法尼醇 X 受体(FXR)、Takeda G 蛋白偶联受体 5(TGR5)和孕烷 X 受体(PXR)等受体发挥免疫调节作用。这些受体的激活可抑制 NF-κB 通路,从而抑制促炎性 Th17 细胞反应并促进 Treg 扩增,维持免疫平衡。色氨酸主要通过三条途径代谢:吲哚胺 2,3-双加氧酶(IDO1)催化生成犬尿氨酸、色氨酸羟化酶 1(TPH1)催化生成 5-羟色胺,以及肠道菌群催化生成吲哚衍生物。这些代谢产物可激活芳香烃受体(AhR)信号通路,诱导下游细胞色素 P450 酶(CYP1A1、CYP1A2)及 IL-22 分泌,从而限制炎症并维持肠道免疫平衡。 4、通过重建肠道菌群以调控宿主免疫 图4. 调控肠道菌群的策略。 肠道菌群的调控可分为直接干预与间接调节两大类。 直接干预包括粪菌移植(FMT),即将健康供者的粪菌悬液通过口服或灌肠途径引入受者肠道,以重建微生态平衡;亦可补充特定益生菌,直接放大有益菌群。 间接策略则通过改造肠道微环境,为有益菌的定植与增殖创造有利条件,例如:调整膳食结构——减少高脂高糖食物,增加富含益生元及膳食纤维的食品(鱼类、乳制品、全谷物等); 降低身心应激——规律运动、充足睡眠。 综合上述措施,可促进益生菌定植,维护肠道健康。 总之,肠道炎症与免疫稳态受 CD4⁺ T 细胞精密调控,而其功能又显著受制于肠道菌群代谢产物。菌群失调(即微生物群落组成紊乱及其代谢谱改变)会把免疫平衡推向过度炎症状态,IBD 即典型例证。通过粪菌移植、益生菌或膳食干预重建健康菌群,已被证实可重新校准免疫应答并减轻肠道炎症。未来,深入解析菌群—CD4⁺ T 细胞互作将为防治策略开辟新途径。生命早期定植尤为关键:分娩方式、母乳喂养等因素造成的婴儿菌群差异,可显著影响终生免疫健康,并决定日后免疫介导疾病的易感性。因此,研究应优先探索益生菌/益生元精准干预以促进早期定植。与此同时,成人微生物组疗法亦需深化研究;个体化菌群药物、精细化膳食以及可选择性增强有益代谢物的新一代工程益生菌,正引领慢性肠道炎症管理进入范式转变。概言之,靶向“菌群—CD4⁺ T 细胞”轴为调控肠道炎症提供广阔前景;未来须同步推进生命早期预防策略与成人治疗方案,这一整合路径将在人类与动物健康领域产生协同收益。 参考文献 Ziyu Ma , Zixu Wang, Jing Cao et al. Regulatory roles of intestinal CD4+ T cells in inflammation and their modulation by the intestinal microbiota. Gut Microbes . 2025 Dec;17(1):2560019.