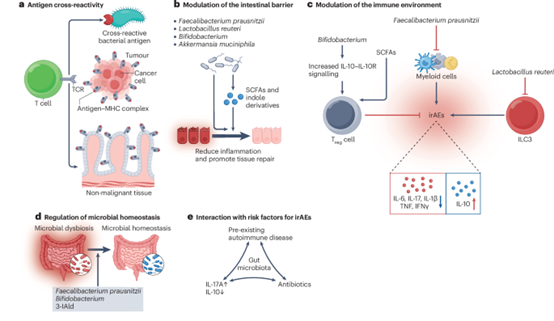
免疫检查点抑制剂(ICIs)是癌症治疗领域的一项重大突破;其应用使多种肿瘤类型患者的治疗效果得到改善。然而,ICIs也可能引发一系列免疫相关不良事件(irAEs),这对这些治疗的有效性和安全性构成了相当大的挑战。研究表明,肠道微生物群在调节肿瘤免疫微环境中发挥着关键作用,从而影响ICIs的疗效。越来越多的证据表明,肠道微生物群的组成和功能的改变也与irAEs风险增加有关,特别是ICI诱导的结肠炎。事实上,这些肠道微生物群的变化可能促进了irAEs的发病机制。 在本综述中,作者首先总结了irAEs目前带来的临床挑战。然后,作者重点关注了肠道微生物群的改变与irAEs之间的相关性,尤其是ICI诱导的结肠炎,并推测了这些微生物变化影响irAEs发生的机制。最后,作者强调了肠道微生物变化作为预测irAEs的生物标志物的潜在价值,并讨论了可能作为管理irAEs新策略的肠道微生物干预措施,包括粪菌移植、益生菌、益生元和/或后生元补充剂以及饮食调整。 免疫检查点抑制剂(ICIs)的问世是癌症治疗领域的一项革命性突破。ICIs通过抑制PD-1、PD-L1和CTLA4等免疫抑制分子来促进免疫介导的癌细胞破坏,这些分子常常限制肿瘤反应性T细胞的活性。尽管ICIs在多种肿瘤类型中显著改善了患者的治疗效果,但这些药物的有效性受到低反应率、获得性耐药以及免疫相关不良事件(irAEs)的限制。irAEs是由于过度激活的免疫系统对各种非恶性组织产生的非靶向效应所致。接受ICI单药治疗的患者中irAEs的发生率可高达50%,其中3至4级严重irAEs通常发生在约20%至30%的患者中;在接受抗PD-1和抗CTLA4抗体联合治疗的患者中,发生率更高,高达60%的患者会出现高级别irAEs。在发病时间方面,接受抗CTLA4和抗PD-1抗体联合治疗的患者中,致命性irAEs通常在治疗开始后约15天内发生,而接受ICI单药治疗的患者中,此类事件的发生时间则更为延迟,约为40天。irAEs几乎可以影响任何器官,但最常涉及皮肤、肠道、肝脏或内分泌腺。有趣的是,发生irAEs的患者往往对ICIs有更好的反应,多项研究表明,在考虑了领先时间和不朽时间偏倚后,与未发生irAEs的患者相比,发生irAEs的患者无进展生存期(PFS)和/或总生存期(OS)显著更长。 临床上,ICI诱导的irAEs的表现与相同器官的自身免疫或炎症性疾病(或两者兼有)相似。例如,ICI介导的结肠炎的表现与溃疡性结肠炎或克罗恩病相关的结肠炎相似。目前,尚未为irAEs建立特定的治疗方案,经验性使用类固醇作为一线治疗,并在难治性病例中辅以其他免疫抑制剂,例如TNF和IL-6激动剂。与自身免疫或炎症性疾病的治疗不同,irAEs的管理必须考虑免疫抑制剂对肿瘤学结果的潜在影响。事实上,皮质类固醇(尤其是高剂量)和免疫抑制剂可能会对ICIs的疗效产生负面影响,严重的irAEs通常需要停止ICI治疗。因此,开发新的治疗策略以缓解irAEs,同时增强——或至少不损害——ICIs的疗效是一个重要的挑战。 人类肠道微生物群及相关微生物代谢产物在宿主代谢、炎症和免疫过程中发挥着关键作用。大量研究表明,肠道微生物群和微生物群衍生的代谢产物调节局部和全身免疫反应,从而影响晚期癌症患者对ICIs的疗效。越来越多的临床前和临床研究证据表明,肠道微生物群在irAEs中也发挥着重要作用。此外,接受粪菌移植(FMT)治疗的皮质类固醇难治性ICI诱导结肠炎患者已获得成功。对接受ICIs治疗患者的粪便样本进行高通量宏基因组测序分析发现,在后续发生irAEs的患者中,基线时潜在致病菌如肠道拟杆菌富集,而潜在有益微生物如拟杆菌、瘤胃球菌、双歧杆菌、Faecalibacterium prausnitzii和乳酸菌则减少。在ICI诱导的irAEs小鼠模型中,双歧杆菌、F. prausnitzii和乳酸菌的保护作用得到了重现。宏基因组测序数据还发现了与irAEs相关的肠道微生物群代谢变化。例如,在发生irAEs的患者中,基线时涉及产生某些有益代谢产物(包括丁酸等短链脂肪酸(SCFAs))的微生物途径被低估。在生理和病理条件下,包括癌症以及ICI治疗背景下,肠道微生物群与免疫细胞之间的相互作用已有充分记录。关于irAEs,特别是ICI诱导的结肠炎,肠道微生物群或相应的代谢产物可以通过对结肠免疫细胞(如调节性T(Treg)细胞、髓系细胞和天然淋巴细胞(ILCs))的影响或对炎症因子的调节,发挥保护性或致病性作用。 在此,作者首先简要概述了ICI诱导的irAEs带来的主要临床挑战,然后将注意力转向肠道微生物群与这些毒性之间的相关性和机制联系。鉴于这些关联,作者强调了利用特定肠道微生物菌株或分类单元的丰度差异来预测irAEs的可能性,以及通过粪菌移植、益生菌、益生元和/或后生元补充剂或调整饮食模式来调节肠道微生物群,以治疗甚至预防irAEs的潜在机会。 irAEs带来的临床挑战 本期刊之前的几篇综述文章已经总结了irAEs的表现、诊断和管理。美国临床肿瘤学会、欧洲医学肿瘤学会、癌症免疫治疗毒性管理工作组以及国家综合癌症网络制定了指南,以帮助临床医生有效管理irAEs。在此,作者仅简要总结与irAEs相关的重大临床挑战和未满足的需求。 irAEs的诊断 irAEs的诊断主要依赖于受累器官的症状、与ICI使用的时间相关性、病理检查以及排除其他常见不良事件的原因。考虑到irAEs的不可预测性以及严重的irAEs可能导致ICI治疗中断和受累器官的不可逆损伤,持续努力识别用于预测或早期诊断irAEs的生物标志物至关重要。鉴于血液检测的便利性和微创性,越来越多的研究旨在识别能够预测irAE发生的血液学特征。例如,一项研究分析了在接受ICIs治疗前后收集的黑色素瘤患者的外周血样本,发现两个基线特征(高丰度的活化CD4+记忆T细胞(定义为CD45ROhiCD45RAloCD27lo T细胞,在蛋白水平表达CD38、HLA-DR和/或Ki67,或在mRNA水平表达HLA-DX或MKI67)和更具克隆多样性的T细胞受体(TCR)库)作为严重irAEs(≥3级)的有前景的预测因子,与ICI方案和受累器官无关。其他研究则关注血液中某些因素与器官特异性irAEs之间的联系,如ICI诱导的甲状腺炎、肝炎和1型糖尿病。然而,目前还没有针对任何irAEs的预测生物标志物经过验证并整合到常规临床实践中,需要进一步研究。 irAEs的治疗 一般来说,患有非严重irAEs(1至2级)的患者应接受针对症状的干预措施,必要时使用皮质类固醇,并在不停用ICI的情况下进行密切监测。低级别心肌炎是一个例外,在这种情况下,应停用ICIs。相比之下,对于任何患有严重irAE的患者,应停用ICIs并开始免疫抑制治疗。推荐将皮质类固醇作为irAEs的一线治疗方案。对于依赖皮质类固醇或对皮质类固醇耐药的irAEs,推荐的二线免疫抑制剂包括英夫利西单抗和维多珠单抗。抗肿瘤坏死因子(TNF)抗体英夫利西单抗被推荐用于胃肠道和心脏irAEs以及ICI相关肺炎的二线治疗,但不推荐用于免疫相关性肝炎。其他报告也证实了抗整合素α4β7抗体维多珠单抗在治疗ICIs诱导的皮质类固醇依赖性或耐药性肠炎患者中的有效性。但是需要进一步的临床研究来评估在治疗ICI诱导的结肠炎时使用维多珠单抗是否会损害ICI反应。值得注意的是,临床前数据表明,抗生素诱导的肠道菌群失调和Enterocloster clostridioformis的重新定植通过影响胆汁酸代谢来降低MAdCAM1的表达,从而促进ICI耐药,这可以通过粪菌移植来逆转。 因此,迫切需要新的策略来治疗irAEs而不损害ICIs的疗效。已经提出了几种潜在的策略来应对这一临床挑战。第一种策略是修改ICIs或ICI方案(例如,临床前研究表明,使用缺乏Fc效应功能的CTLA4拮抗剂可能会减少irAEs而不损害抗肿瘤疗效)。第二种策略是更有针对性地抑制参与irAEs发病机制的特定炎症因子。临床前和临床数据表明,TNF抑制剂以及IL-6抑制剂可以成功治疗ICI诱导的结肠炎,同时增强抗肿瘤疗效;Janus激酶(JAK)抑制剂也可能是潜在的治疗选择。最后,鉴于肠道菌群已被证明会影响irAEs的风险和严重程度,第三种策略是调节菌群(例如,通过粪菌移植),这有可能减轻irAEs而不损害,甚至可能增强ICIs的抗肿瘤疗效。有研究报告了第一例接受粪菌移植治疗的难治性ICI诱导结肠炎患者病例系列,为调节肠道菌群可以消除irAEs提供了证据。几项正在进行的临床试验正在进一步评估粪菌移植对irAEs的治疗效用,包括NCT04883762、NCT06206707和NCT03819296。 irAEs的风险因素 鉴于irAEs目前不可预测的发生和可能的严重后果,识别irAEs的风险因素至关重要。迄今为止,尚未建立经过验证的临床风险因素。潜在的风险因素多种多样,包括肿瘤类型、ICI类型、患者性别、合并症、先前治疗、同时用药、预先存在的自身抗体和自身反应性T细胞、细胞因子水平、循环血液细胞亚群、肠道菌群组成和遗传易感性。需要大规模队列研究和临床前研究来验证这些风险因素的预测价值。 肠道微生物群与irAEs之间的联系 多条证据表明肠道微生物群会影响irAEs的风险。irAEs几乎可以涉及任何器官,但主要发生在微生物定植较多的部位,如皮肤和胃肠道,这表明微生物群可能在其中起到了机制性的作用。此外,抗生素的使用通常与irAEs风险增加有关,尽管这种影响因总体暴露水平、抗菌谱和抗生素治疗的时机而存在不一致的效果。对患有irAEs患者的肠道微生物群进行的高通量测序分析揭示了微生物组成和功能途径的统计学显著变化。病例报告还描述了从ICI诱导的肠炎发病到缓解期间肠道微生物群的变化。肠道微生物群对irAEs的影响在ICI诱导的结肠炎方面得到了特别深入的研究,无论是在临床队列还是临床前模型中。与临床情况不同,ICIs单独通常不会在常用的实验小鼠品系中诱导结肠炎,这可能至少部分是由于它们独特的微生物群。然而,使用被源自野生小鼠的参考肠道微生物群定植的小鼠成功建立了抗CTLA4抗体诱导的结肠炎模型,为这种irAE依赖于肠道微生物群的组成提供了证据。 还有多条证据表明肠道微生物群与肠外irAEs之间存在相关性。对超过18000名接受ICIs治疗的肺癌患者的FDA不良事件报告系统(FAERS)数据进行的回顾性分析发现,抗生素的使用与特定器官或器官系统的irAEs有关。具体来说,抗生素的使用与irAEs的风险显著增加有关,比值比为1.69至2.54,包括:肾脏和泌尿系统irAEs(包括肾小管间质性肾炎);肝胆系统irAEs(肝炎);血液和淋巴系统irAEs(如中性粒细胞减少症、贫血和血小板减少症);以及呼吸、胸腔和纵隔irAEs(包括肺炎和心包炎)。在同项研究中,对VigiBase数据的分析证实了在这些患者中,抗生素使用与血液或淋巴系统以及呼吸、胸腔或纵隔irAEs风险显著增加有关。一项涉及肺癌患者的宏基因组学研究识别出许多irAE相关细菌物种基因组中编码的具有自身免疫潜力的肽段模拟物,包括普雷沃菌属的Copri、拟杆菌属的Dorei、Blautia glucerasea和草绿色链球菌。这些模拟肽段包括涉及影响肠外组织(如皮肤和结缔组织以及甲状腺)自身免疫疾病的抗原表位。因此,微生物抗原与自身抗原之间的交叉反应,也被称为分子模拟,可能是肠道微生物群与肠道或肠外irAEs之间关联的基础。在此,作者进一步总结了肠道微生物改变与irAEs之间的已报告的分类学(表1)和分子学关联。 肠道微生物群在irAEs中的作用机制 irAEs的病理生理机制尚未完全明确。irAEs可能类似于自身免疫性疾病或炎症性疾病,或两者兼有。目前文献中提出的潜在机制包括抗原交叉反应、预先存在的自身抗体或自身反应性T细胞的激活、T细胞库多样性增加以及遗传易感性,这些与自身免疫性疾病的发病机制重叠,还包括广泛的免疫激活和促炎因子的释放,这反映了炎症性疾病的发病机制(框1)。之前的几篇综述文章详细讨论了irAEs的发病机制。在此,作者重点关注肠道微生物群对这些机制的潜在贡献(图1)。 框1:irAEs的发病机制 1)抗原交叉反应:某些肿瘤抗原可能与自身抗原有相似的表位,导致免疫系统对自身组织产生攻击。 2)自身抗体或自身反应性T细胞的激活:预先存在的自身抗体或自身反应性T细胞可能被ICIs激活,引发自身免疫反应。 3)T细胞库多样性增加:ICIs治疗可能导致T细胞库多样性增加,从而增加对自身抗原的反应性。 4)遗传易感性:某些个体可能因遗传因素而更容易发生irAEs。 5)广泛的免疫激活:ICIs治疗可能导致广泛的免疫激活,释放促炎因子,引发炎症反应。 图1:肠道微生物群与irAEs之间联系的潜在机制。报告的免疫相关不良事件(irAEs)与肠道微生物群的组成和/或特定成分之间的关联存在几种潜在机制。a,抗原交叉反应。在与irAEs相关的微生物物种的基因组中已经识别出许多具有自身免疫潜力的肽段模拟物。因此,自身抗原(自身抗原)和微生物抗原之间的交叉反应可能是irAEs的基础。b,肠道屏障破坏与肠道炎症易感性增加有关。某些细菌及其产生的有益代谢产物已被证明可以通过影响紧密连接、黏蛋白产生和调节性T(Treg)细胞来缓解肠道炎症并增强肠道屏障的修复和完整性,从而可能减轻irAEs。c,调节免疫环境和稳态。在irAEs的背景下,已经识别出肠道微生物群与免疫细胞之间的各种相互作用。例如,双歧杆菌和细菌代谢产物,如短链脂肪酸(SCFAs),可以在回肠中诱导免疫抑制性Treg细胞,从而缓解结肠炎症和irAEs。Faecalibacterium prausnitzii可以抑制结肠髓系细胞的浸润,从而改善免疫检查点抑制剂(ICI)诱导的结肠炎。Lactobacillus reuteri已被证明可以抑制结肠3型天然淋巴细胞(ILC3)并消除ICI诱导的结肠炎。因此,这些细菌也与各种促炎细胞因子水平降低和抗炎因子如IL-10水平增加有关。d,调节微生物稳态。粪菌移植(FMT)已成功应用于治疗对皮质类固醇耐药的ICI诱导结肠炎患者,并在受者中观察到肠道微生物群的重建。同样,Faecalibacterium prausnitzii、双歧杆菌和吲哚-3-羧醛(3-IAld)补充可以通过重塑肠道微生物群组成来缓解ICI诱导的结肠炎,从而促进微生物稳态。e,与irAEs风险因素的相互作用。与各种因素(包括预先存在的自身免疫性疾病、抗生素使用和细胞因子水平)相关的irAEs风险可以通过与肠道微生物群的相互作用来改变;因此,某些微生物群成分的富集或代表性不足可以促进或保护irAEs。IL-10R,IL-10受体;TCR,T细胞受体。 肠道微生物群在irAEs中的预测和治疗潜力 本文所述的发现强调了越来越多的证据表明,患有irAEs的患者的肠道微生物群组成常常发生改变。这些独特的肠道微生物特征可能作为irAEs的早期预警指标。将这些特征与ICIs反应或耐药背后的微生物标志物相结合,可能会指导接受此类药物治疗的癌症患者的管理。考虑到肠道微生物及其代谢产物在irAEs中的作用,调节肠道微生物群也为改善irAEs的治疗提供了有前景的策略。此类调节的主要方法包括粪菌移植(FMT)、饮食改变以及益生菌、益生元和/或后生元。几项正在进行的临床试验正在评估肠道微生物生物标志物用于irAEs和/或调节肠道微生物群治疗irAEs。 微生物群特征作为预测生物标志物 多项大规模队列研究已在发生irAEs的患者中识别出独特的肠道微生物组成。其中一些研究基于观察到的肠道微生物群的差异构建了分类器,以预测irAEs的发生。例如,前文提到的由Hu等人开发的基于机器学习的随机森林分类器,在预测抗PD-(L)1抗体相关irAEs方面表现出强大的区分能力(AUC值为0.88)。利用该分类器,在研究间转移验证中,AUC值范围在0.65到0.89之间,平均值为0.74。在另一项研究中,Andrews等人发现,在发生irAEs的患者中,拟杆菌(B. intestinalis)和肠杆菌(I. bartlettii)更为丰富,而在未出现此类毒性反应的患者中,厌氧乳酸发酵菌(Anaerotignum lactatifermentans)和甲酸生成菌(Dorea formicigenerans)更为丰富。在多变量逻辑回归模型中调整临床预测因子后,研究人员发现,拟杆菌与irAEs风险显著增加相关,而甲酸生成菌似乎具有保护作用;然而,该研究未确定AUC值。此外,拟杆菌、Faecalibacterium prausnitzii、双歧杆菌和乳酸杆菌似乎对irAEs具有保护作用。在癌症患者中,这些细菌在粪便中的代表性不足可能表明发生irAEs的风险更高。值得注意的是,微生物特征似乎与抗CTLA4和抗PD-(L)1抗体诱导的irAEs存在差异性关联,因此可能需要为不同的ICI方案构建不同的微生物分类器。其他分类器,如免疫特征,也有望用于预测irAEs。是否将微生物特征与免疫特征相结合能够更准确地预测irAEs,尚需进一步研究。目前,这些预测特征距离临床应用还很遥远,在应用于临床实践之前,需要更多的临床证据。 调节肠道微生物群以治疗irAEs的潜在策略 » 粪菌移植(FMT) 两名患有免疫检查点抑制剂(ICI)相关结肠炎且对皮质类固醇和免疫抑制剂耐药的患者,通过粪菌移植(FMT)成功治愈,这表明FMT在治疗免疫相关不良事件(irAEs)方面具有潜在的治疗价值。几项正在进行的临床试验,包括NCT04883762、NCT06206707和NCT03819296(补充表1),正在评估FMT在治疗ICI诱导的腹泻和/或结肠炎患者中的安全性和有效性。尽管FMT已被证明有效,但仍存在关于选择合适供体、建立标准化且广泛可行的方案以及潜在不良反应的问题。 » 饮食调整 较低水平的纤维或ω3摄入(反映西方饮食模式)以及由此产生的微生物群与irAEs的发生有关。模拟禁食的饮食可以减少小鼠模型中ICI诱导的irAEs,同时增强抗肿瘤免疫。正在进行的临床试验(NCT05832606和NCT06438588)正在评估特定饮食干预是否可以缓解irAEs。 » 益生菌 益生菌,包括乳酸菌和双歧杆菌属的经典益生菌种类,以及下一代益生菌,如Akkermansia、拟杆菌和Faecalibacterium菌株或细菌群落,可能提供一种潜在策略来缓解irAEs并促进抗肿瘤免疫。 » 益生元 益生元,如抗性淀粉、果胶、菊粉、人参多糖和卡斯他尼苷等可被细菌代谢的膳食成分,已通过其对肠道微生物群及其相关代谢产物的有利影响显示出有益效果。 » 后生元 后生元是非活性微生物和/或其成分,如短链脂肪酸、脂多糖和胞外多糖。与益生菌和FMT相比,后生元可能具有稳定性和安全性优势,为irAEs提供另一种有前景的治疗途径。 免疫检查点抑制剂(ICIs)彻底改变了癌症治疗的格局,但免疫相关不良事件(irAEs)却带来了相当大的挑战。越来越多的证据表明,肠道微生物群的组成以及某些微生物代谢产物在irAEs的风险和发病机制中具有重要意义,并可能具有治疗潜力。然而,要推进这一研究领域,需要解决与肠道微生物群和irAEs研究相关的几个基本问题。 首先,需要开发出可靠的irAEs临床前模型。目前,还没有小鼠模型能够完全复制人类irAEs的发病机制。以ICI诱导的结肠炎为例,ICIs单独使用并不能在常用的实验小鼠品系中诱导结肠炎。实验小鼠发生ICI诱导的结肠炎需要使用具有遗传易感性的品系或其他炎症刺激,如DSS,而这些方法可能无法真实地再现患者体内涉及的机制。令人惊讶的是,有研究表明抗CTLA-4抗体可以在被野生小鼠肠道微生物群定植的实验小鼠中诱导结肠炎,这突显了微生物群组成在ICI诱导结肠炎发展中的重要性。 其次,需要开展大规模的回顾性和前瞻性队列研究。目前,只有少数临床研究评估了肠道微生物群与irAEs之间的关系,且样本量较小。大规模的回顾性和前瞻性队列研究常常受到方法学挑战(如有限的技术专长以及宏基因组和代谢组分析的高成本)和/或样本可用性有限的限制,这些问题需要得到解决。 第三,需要更好地定义、优化和标准化调节肠道微生物群的临床治疗策略。目前的策略,如粪菌移植(FMT)、益生菌和/或益生元的补充以及饮食调整,仍然存在上述担忧。需要进一步考虑治疗效果的稳定性、干预的时机、间隔和持续时间,以及如何最小化不良反应并确保安全性。需要开展大规模的分析研究以及设计良好的验证研究,以建立合适的方法。 最后,鉴于irAEs的发生通常与对ICIs的更好反应相关,这可能是因为它们具有重叠的免疫学机制,有人可能会推测调节肠道微生物群和微生物代谢产物会对ICI的疗效和irAE风险产生矛盾的影响;然而,事实并非如此。在ICI治疗前使用抗生素与免疫治疗无反应和irAEs的发生均有关联。相反,像F. prausnitzii、双歧杆菌、乳酸菌等细菌与ICI反应和irAEs的有益效果相关。据报道,微生物短链脂肪酸(SCFAs)在irAEs背景下水平降低,并且可以增强抗肿瘤免疫。因此,这些对ICI疗效和irAEs都有良好影响的细菌菌株和代谢产物作为新的治疗策略用于临床转化具有相当大的潜力。 总之,利用肠道微生物群来改善irAEs管理具有巨大的潜力。然而,需要进一步开展大规模队列临床研究以及相关临床前研究,以识别能够同时减轻irAEs并增强ICIs疗效的微生物菌株和代谢产物,并探索其背后的机制。最终,需要开展干预性试验来验证涉及这些微生物菌株和代谢产物的治疗策略的临床应用价值。 参考文献 Gao Ya-Qi , Tan Yong-Jie , Fang Jing-Yuan. Roles of the gut microbiota in immune-related adverse events: mechanisms and therapeutic intervention. Nat Rev Clin Oncol. 2025 May 14. doi: 10.1038/s41571-025-01026-w.