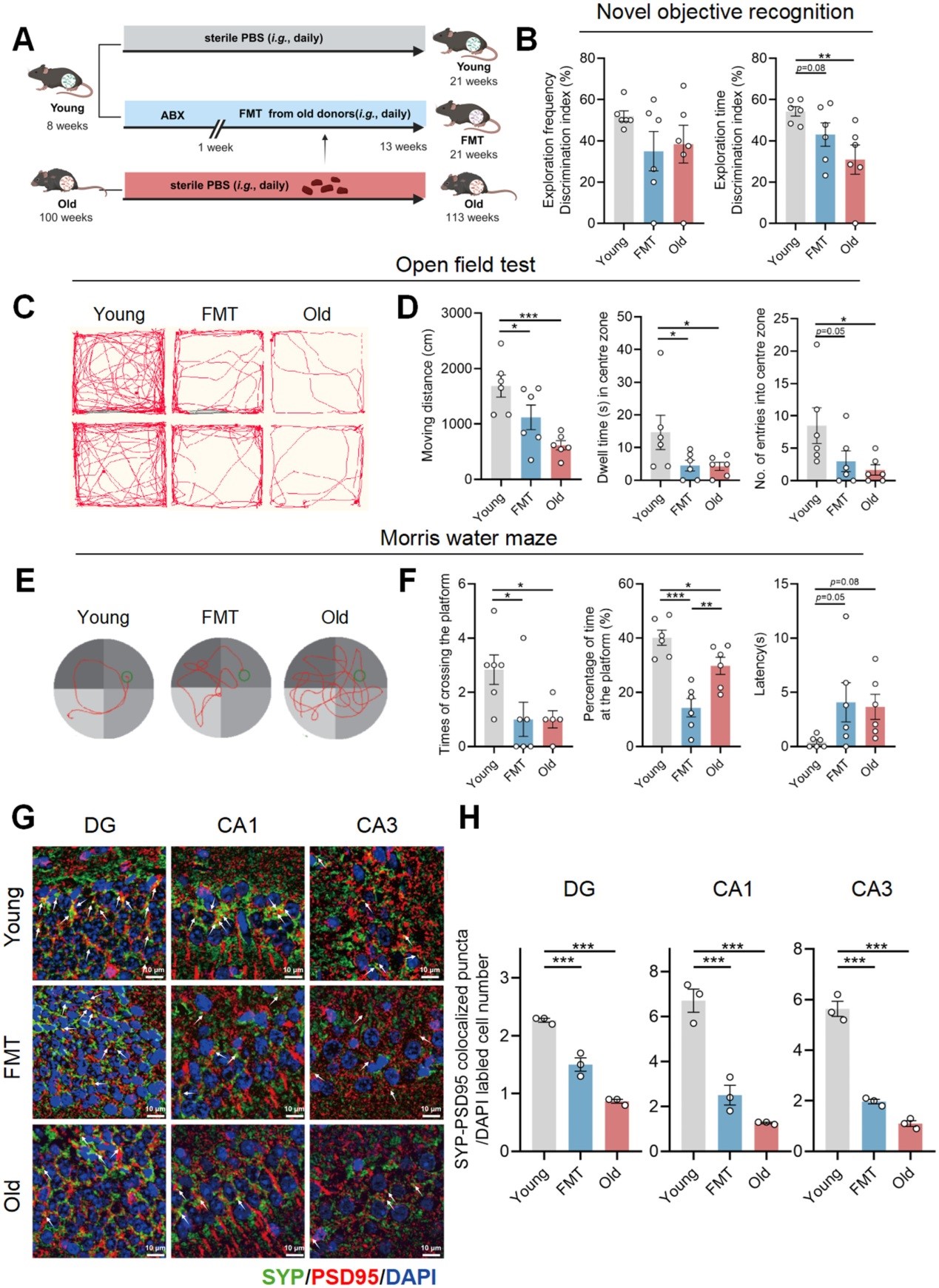
衰老过程中肠道微生物群的改变是衰老相关认知能力下降的原因之一,衰老的早期特征是海马突触丧失。然而,肠道菌群对衰老过程中海马突触丢失的影响及其机制作用尚不清楚。多组学分析显示,衰老的肠道菌群以双歧杆菌假长亚种(B.p)和色氨酸代谢产物吲哚乙酸(IAA)在外周和大脑中的明显变化为特征。这些特征也在移植了衰老肠道菌群的年轻受体小鼠中得到了重现。与健康受试者相比,认知障碍患者的粪便中B.p丰度降低,并且与认知评分呈正相关。来自B.p丰度较低的患者肠道菌群移植的小鼠表现出比B.p丰度较高的患者更差的认知行为。同时,补充B.p能够产生IAA,并增强外周和大脑中IAA的生物利用度,以及改善5×FAD转基因小鼠的认知行为和小胶质细胞介导的突触丢失。B.p产生的IAA被证明可以通过依赖芳香烃受体的方式防止小胶质细胞吞噬突触。本研究揭示了衰老的肠道菌群诱导的认知衰退和小胶质细胞介导的突触丢失,至少部分是由于B.p及其代谢产物IAA的缺乏。它为通过调节肠道益生菌及其色氨酸代谢产物来预防神经退行性疾病提供了一种概念验证策略。 1、 衰老的肠道菌群可诱导年轻受体出现认知衰退和海马突触丢失。 作者首先通过粪菌移植(FMT)实验来研究衰老的肠道菌群是否会导致年轻小鼠的认知行为紊乱。结果显示,接受移植的年轻小鼠(FMT组)在认知行为测试中表现出了认知能力下降和海马突触丢失的现象。 图1 衰老的肠道菌群可诱导年轻成年受体出现认知衰退和海马突触丢失。 2、衰老的肠道菌群增加海马胶质细胞介导的突触消除。 与年轻对照组相比,FMT组和老年组中有40种与突触结构、活动和组织相关的蛋白表达下降,而4种与内吞作用、溶酶体和吞噬作用相关的蛋白表达增加(图2B),同时观察到突触指标的下降以及与内吞作用和溶酶体蛋白水平升高相关的反应性胶质细胞标记物的增加(图2C)。这些提示衰老的肠道菌群在促进胶质细胞吞噬突触丢失方面发挥了促进作用。 图2 衰老的肠道菌群会扰乱年轻成年受体小鼠海马突触的结构、活动以及与组织相关的蛋白质组,并诱导小胶质细胞介导的突触丢失。 3、衰老的肠道菌群以Bifidobacterium pseudolongum(双歧杆菌假长亚种,B.p)的缺乏和吲哚乙酸(IAA)水平低下为特征。 为了描述衰老肠道菌群的结构和功能,作者对小鼠的粪便宏基因组进行了测序,并对其盲肠内容物进行了代谢组学测序。粪便宏基因组数据显示,年轻小鼠和老年小鼠之间存在不同的分类学特征,其中双歧杆菌假长亚种(Bifidobacterium pseudolongum,B.p)的相对丰度在老年供体和年轻受体中显著降低(图3A、B)。粪便16S rRNA测序显示,在粪菌移植(FMT)期间,年轻受体的肠道微生物模式发生了动态变化,在这一过程中,B.p和黏液阿克曼菌(Akkermansia muciniphila)逐渐减少(图3C–E)。代谢组学分析显示吲哚乙酸(IAA)在老年供体中和FMT小鼠中也有所下降(图3F、G)。老年组和FMT组粪便中IAA与Trp的比例下降(图3H)。与年轻对照组相比,IAA在老年供体和年轻受体的血清和海马中也有所减少(图3I、J)。B.p的丰度与粪便、血清和海马中IAA的浓度呈正相关(图3K)。 图3 缺乏双歧杆菌假长亚种(B.p)的衰老肠道菌群与年轻成年受体小鼠肠道中IAA的产生水平较低以及外周和大脑中IAA的生物利用度较低有关。 4、来自双歧杆菌假长亚种(B.p)丰度较低的患者的微生物群移植会导致更差的认知行为。 与健康对照组(HC)相比,认知障碍患者(CI)粪便中双歧杆菌假长亚种(B.p)的相对丰度降低(图4A)。粪便中IAA水平以及IAA与色氨酸(Trp)的比值在CI患者中也较低(图4B,C)。且B.p丰度与MMSE、MoCA-B等认知评分呈正相关(图4D)。粪便中IAA浓度与血浆中磷酸化tau181(p-tau181)水平呈负相关(图4D)。此外,作者还发现,B.p丰度较低的患者在PET图像上显示出更严重的Aβ和Tau沉积(图4E)。将低B.p丰度认知障碍患者的粪便菌群移植至无菌小鼠后,受体小鼠在开放场地测试中活动轨迹及进入中心区次数减少,海马区小胶质细胞活化标志物IBA-1和CD68表达升高,突触标志物PSD95减少(图4K,L)。 图4 来自双歧杆菌假长亚种(B.p)丰度较低的患者的菌群移植会导致更差的认知行为表现。 5、B.p补充可增加IAA的产生及其生物利用度。 体外实验证实,B.p可直接代谢色氨酸生成IAA,且与老年或患者粪便菌群共培养可提升IAA水平(图5E–G)。作者还通过定殖活的或热灭活的B.p(2×10⁹ CFU/mL),随后口服给予色氨酸-d5(Trp-d5)(图5H),在体内检测了B.p对外周和大脑IAA生物利用度的影响。作者发现,活菌株而非死菌株能够导致小鼠血清和海马中IAA-d5生物利用度的更高水平(图5I)。上述数据表明,B.p能够产生IAA,并增强外周和大脑中IAA的生物利用度。 图5 双歧杆菌假长亚种(B.p)在体外增加了细菌产生IAA的水平,并在体内提高了外周和大脑中IAA的生物利用度。 6、B.p补充可改善认知衰退和小胶质细胞介导的突触丢失。 口服活体B.p可显著提高5×FAD转基因小鼠的肠道IAA产量及外周/脑内IAA生物利用度,改善其认知行为,并抑制小胶质细胞活化和突触吞噬,而热灭活B.p无此效果(图6G-I)。 图6 B.p改善了5×FAD转基因小鼠的认知衰退和小胶质细胞介导的突触丢失,同时提高了外周和大脑中IAA的生物利用度水平。 7、IAA通过依赖芳香烃受体(Aryl Hydrocarbon Receptor, AhR)的方式防止小胶质细胞吞噬突触。 在体外实验中,IAA能够以剂量依赖的方式抑制LPS诱导的BV-2微胶质细胞的激活,表现为Iba-1和Cd68基因表达的降低以及NLRP3、Caspase1、NFκB等炎症相关蛋白的表达下调。此外,IAA还能够减少LPS诱导的微胶质细胞对突触的吞噬作用,且这种作用依赖于芳烃受体(AHR)的激活。当与AHR拮抗剂BAY218联合使用时,IAA对微胶质细胞激活和突触吞噬的抑制作用被显著削弱。 图7 IAA以芳香烃受体(AHR)依赖的方式抑制LPS诱导的小胶质细胞激活和小胶质细胞介导的突触丢失。 本研究揭示了衰老的肠道菌群可以诱导认知衰退和小胶质细胞介导的突触丢失。认知障碍患者的粪便中双歧杆菌假长亚种(B.p)的丰度降低,而来自B.p丰度较低患者的菌群移植会导致小鼠表现出更差的认知行为。补充B.p能够改善与衰老相关的认知衰退,并通过激活IAA/芳香烃受体(AHR)信号通路来防止小胶质细胞吞噬突触。未来可探索B.p-IAA联合疗法,或开发靶向AHR的小分子药物,推动“肠-脑轴”精准医学的发展。 参考文献 Li M , Bao Y , Ren J, et al. Aged Gut Microbiota Contributes to Cognitive Impairment and Hippocampal Synapse Loss in Mice. Aging Cell.. 2025 Apr 12:e70064. doi: 10.1111/acel.70064.