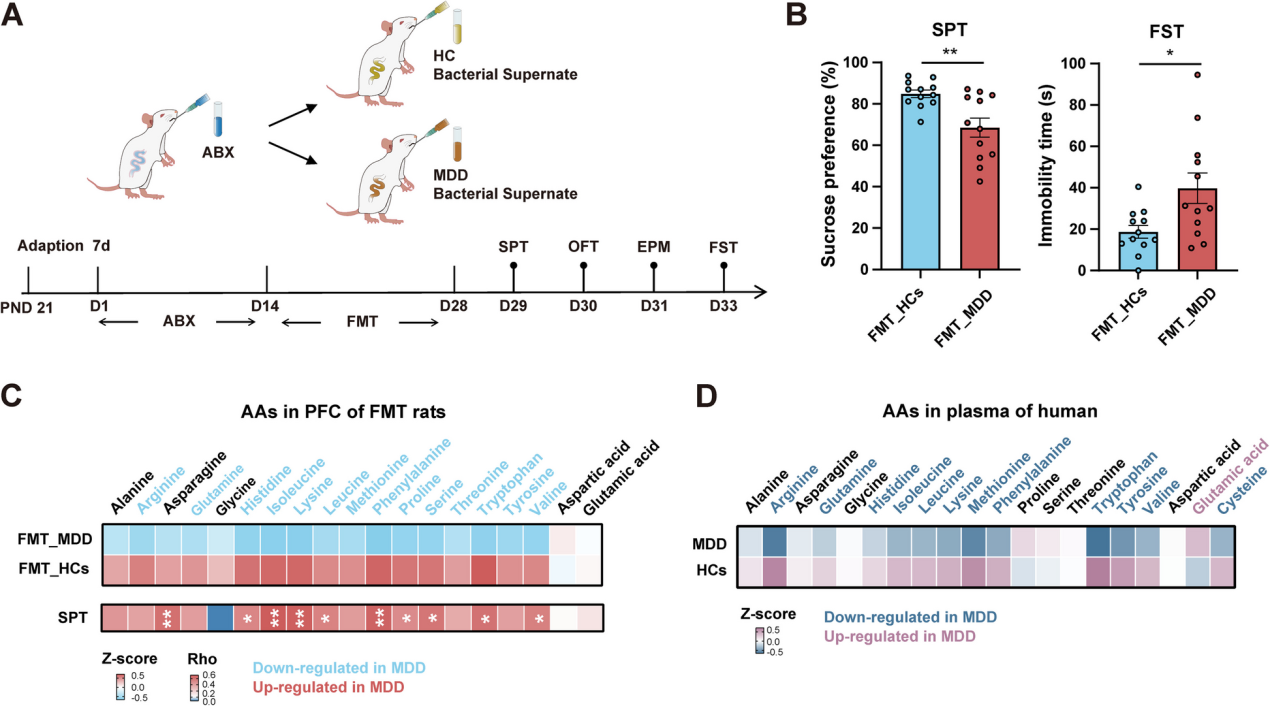
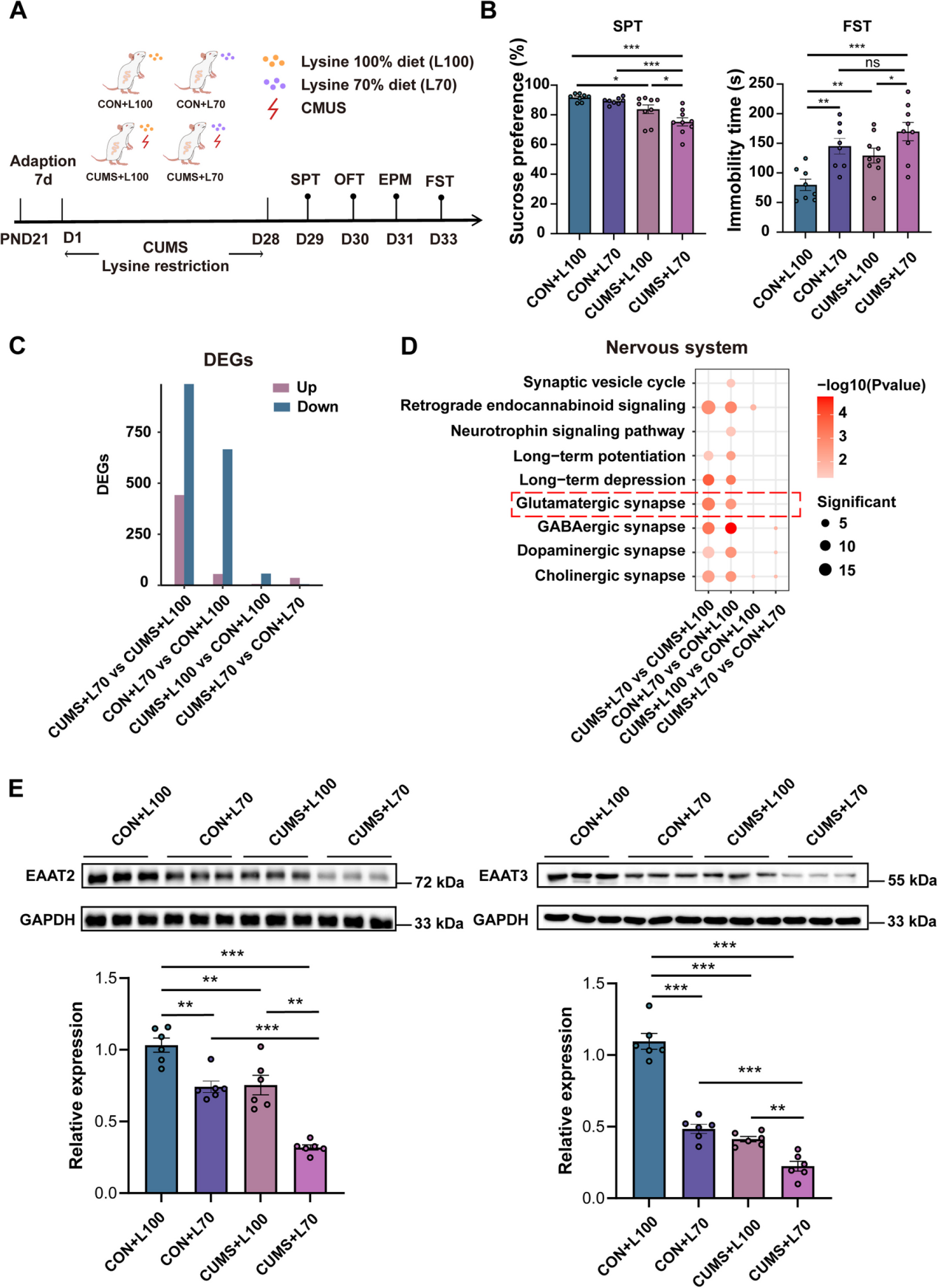
儿童和青少年的主要抑郁症(MDD)是一个日益严重的全球公共卫生问题。微生物群-肠-脑(MGB)轴的代谢变化被认为与MDD的病理生理学有关,但其在儿科人群中的具体作用尚不清楚。作者对256名儿童和青少年的MDD患者以及307名健康对照者进行了多组学研究,整合了血浆代谢组学、粪便宏基因组学以及大脑的静息态功能磁共振成像(rs-fMRI)。对360种差异表达代谢物(DEMs)进行KEGG富集分析显示,血浆氨基酸(AA)代谢存在显著缺陷。作者发现了58种在MDD中富集的菌株和46种在MDD中耗竭的菌株,以及在粪便宏基因组学中6个改变的氨基酸代谢模块。Procrustes分析揭示了改变的肠道微生物群与循环AA代谢之间的关联。因果分析表明,血浆AAs可能介导了改变的肠道微生物群对抑郁和焦虑症状的影响。此外,rs-fMRI显示,额叶的连接缺陷与抑郁和22种AA代谢中的DEMs有关。此外,将MDD患者的粪便微生物群移植到青少年大鼠中,诱导了抑郁样行为和前额叶皮质(PFC)中14种氨基酸的缺乏。此外,饮食中赖氨酸的限制通过降低PFC中兴奋性氨基酸转运蛋白的表达,增加了青少年大鼠对抑郁的易感性。研究结果表明肠道微生物群的改变导致了AAs的缺乏,特别是赖氨酸,在儿童和青少年MDD的发病机制中起着关键作用。靶向AA代谢可能为儿科抑郁症提供新的治疗策略。 1、儿童和青少年抑郁症患者的血浆氨基酸缺乏 为了研究儿童和青少年抑郁症的代谢特征,作者招募了256名MDD患者和307名健康对照者。采用液相色谱-质谱联用(HILIC-MS)和反相液相色谱-质谱联用(RPLC-MS)进行分析,识别出360种差异表达代谢物(DEMs),其中与健康对照者相比,抑郁症患者中有297种血浆代谢物表达下调,63种表达上调(图1B)。对DEMs进行KEGG富集分析,在2级水平上识别出31条失调的代谢通路,在3级水平上识别出122条通路。氨基酸代谢是富集程度最高的2级KEGG通路(图1C),涉及13条3级通路,如精氨酸和脯氨酸代谢、酪氨酸代谢以及赖氨酸生物合成(图1D)。此外,在碳水化合物代谢和消化系统通路中也发现了显著变化(图1C),这些通路已知与抑郁症相关。 在人类肽和蛋白质中存在的20种氨基酸(AAs)中,有13种氨基酸显著失调,包括8种必需氨基酸(赖氨酸、蛋氨酸、色氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸和组氨酸)、2种条件必需氨基酸(半胱氨酸和酪氨酸)以及3种非必需氨基酸(精氨酸、谷氨酰胺和谷氨酸)。此外,在儿童和青少年抑郁症患者中,5-羟色氨酸—色氨酸(一种必需氨基酸)在血清素生物合成中的中间代谢物——表达下调,这表明在生长过程中对必需氨基酸的需求增加可能促成了这些氨基酸在抑郁症背景下发生改变,因为它们直接发挥作用或作为神经递质的前体。图1E提供了氨基酸代谢变化的总结。总体而言,这些发现表明,患有抑郁症的儿童和青少年的血浆代谢组发生了显著变化,特别是在参与神经递质和蛋白质合成的氨基酸中。 图1 儿童和青少年抑郁症患者的血浆氨基酸缺乏 2、儿童和青少年抑郁症患者存在的特定粪便微生物生态系统 鉴于宿主氨基酸代谢与肠道微生物群之间的密切联系,作者对上述队列中的83名MDD个体和58名健康对照个体的粪便样本进行了宏基因组测序。为了进一步阐明MDD患者和健康对照者之间不同的微生物组成,作者采用LEfSe分析来识别58种在MDD中富集的菌株和46种在MDD中减少的菌株。大多数改变的MAGs属于梭菌纲(图2F)。与成人抑郁症中肠道微生物群失调的发现一致,在作者的青少年抑郁症患者中,作者观察到Eggerthellaceae bin.1648的富集,这被认为会引发炎症,以及Faecalibacterium(bin.16032和bin.21049)和Bifidobacterium animalis(bin.19192)的减少,这些菌株曾被报道具有抗炎和短链脂肪酸(SCFA)产生的功能。有趣的是,Akkermansia(bin.805和bin.46904)在MDD患者中有所增加。为了便于解释与MDD相关的微生物功能,在所有474个KEGG模块中,有20个在MDD组中增加,20个减少。在这些模块中,作者发现有8个属于ATP合成的模块在MDD组中减少,还有6个氨基酸代谢模块在MDD组中发生改变,例如芳香族氨基酸(AAA)和支链氨基酸(BCAA)代谢(图2G)。总之,这些发现表明,在患有抑郁症的儿童和青少年中,肠道微生物群的分类、共现网络和功能都受到了干扰。 图2 儿童和青少年抑郁症患者存在特定的粪便微生物生态系统。 3、儿童和青少年抑郁症中肠道微生物群与宿主循环氨基酸的关联 近期文献报道了肠道细菌驱动的氨基酸(AA)或氨基酸衍生物参与成人抑郁症的发病机制。为了研究儿童和青少年抑郁症患者中改变的肠道微生物群与循环代谢物之间的关联,作者进行了Procrustes分析,结果显示粪便微生物群与血浆代谢组特征之间存在强相关性(图3A)。此外,典型相关分析(CCA)识别出66种氨基酸代谢途径中改变的血浆代谢物和104种改变的粪便MAGs之间的关联,表明氨基酸代谢中的血浆代谢物沿着改变的粪便MAGs的向量明显分离(图3B)。 随后,作者对患有抑郁症的儿童和青少年以及健康对照组进行了MAGs(微生物基因组组装基因组)-氨基酸(AAs)-症状轴的Spearman相关性分析。作者分析了在中介分析中识别的每个MAG中的氨基酸代谢基因簇。在中介分析中识别的15个MAGs在氨基酸代谢途径中表现出完整的生物合成和降解模块的基因组,包括精氨酸、赖氨酸、色氨酸、苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸和蛋氨酸(图3E)。总的来说,这些数据表明特定肠道微生物特征的改变、宿主循环中的氨基酸以及抑郁或焦虑症状的发展之间存在因果推断关系。 图3 儿童和青少年抑郁症患者中粪便微生物组成与宿主循环氨基酸的相互作用 4、儿童和青少年抑郁症中与前额叶功能障碍相关的血浆代谢变化 鉴于血浆代谢特征发生了显著改变,作者接下来试图探讨血浆代谢失调是否与患有抑郁症的儿童和青少年大脑功能活动的改变有关。在抑郁症患者和健康对照者之间,有一个包含27个亚区域之间29个连接的单一网络显著不同(图4A和图4B)。具体来说,与健康对照者相比,患有抑郁症的青少年表现出额顶区域功能连接显著降低(14/29,48.3%),特别是涉及中额叶回(MFG)、上额叶回(SFG)和上顶叶小叶(SPL)的连接。在患有抑郁症的青少年中,还发现了与中颞叶回(MTG)和海马(Hipp)相关的连接发生了显著改变。这些结果与之前的发现大致一致,并进一步强调了前额叶区域的功能障碍与早发性抑郁症的神经机制有关。 随后,作者借助基于连接组的预测建模(CPM)并采用留一法交叉验证,研究了血浆代谢物与大脑功能网络之间的联系。结果发现,共有276种代谢物与大脑功能网络显著相关,其中72种在青少年抑郁症中发生了改变(图4C),例如赖氨酸、蛋氨酸和半胱氨酸。值得注意的是,氨基酸(AAs)在与青少年抑郁症相关的功能连接(FC)相关的代谢物中占比最大(图4D),这表明氨基酸对与抑郁症相关的大脑功能活动具有最强的调节作用。 同时,作者发现在患有抑郁症的青少年中表现出显著功能连接异常的几个枢纽区域被发现与抑郁相关的氨基酸广泛相关,特别是在额叶中的上额叶回(SFG)和眶回。这些结果突出了前额叶功能活动在面对与抑郁症相关的氨基酸失调时的脆弱性,表明了一个潜在的神经通路,介导氨基酸失调和青少年抑郁症之间的关系。 图4 与抑郁症相关的血浆代谢物与大脑功能障碍相关。 5、来自患有抑郁症的儿童和青少年的粪菌移植(FMT)在青少年大鼠中诱导出抑郁样行为,并伴有前额叶皮质中氨基酸的缺乏。 为了进一步评估肠道微生物群在儿童和青少年的氨基酸缺乏以及抑郁症发展中的潜在因果作用,作者将19名患有抑郁症的儿童和青少年或19名健康对照者的微生物群移植到经过抗生素处理的青少年大鼠体内(图5A)。在FMT后2周,FMT_MDD组的大鼠体重较低,并且表现出更多的抑郁样行为。对FMT_HCs组和FMT_MDD组大鼠前额叶皮质(PFC)中的20种氨基酸(AAs)进行靶向代谢组学分析,结果显示FMT_MDD组中有14种氨基酸显著下调(图5C),其中10种氨基酸与糖水偏好呈正相关(图5C)。重要的是,FMT_MDD大鼠PFC中大多数下调的氨基酸也在患有抑郁症的儿童和青少年的血浆中下调(图5D)。总之,研究表明来自患有抑郁症的儿童和青少年的粪菌移植(FMT)在青少年大鼠中诱导出抑郁样行为,并伴有前额叶皮质中氨基酸的缺乏。 图5 来自患有抑郁症的儿童和青少年的粪菌移植(FMT)在青少年大鼠中诱导出抑郁样行为,并伴有前额叶皮质(PFC)中氨基酸(AAs)的缺乏。 6、饮食中赖氨酸的限制可能通过调节前额叶皮质(PFC)中的兴奋性氨基酸转运蛋白(EAATs)增加青少年大鼠CUMS模型对抑郁的易感性。 接下来,作者研究了氨基酸缺乏对抑郁症发病机制的特定影响,特别关注赖氨酸,这是在患有抑郁症的儿童和青少年血浆中最显著下调的必需氨基酸(EAA)。作者采用了一种青少年大鼠的慢性不可预见性温和应激(CUMS)模型,并使其接受赖氨酸限制饮食(含有对照饮食中70%的赖氨酸水平)。总共34只青少年大鼠随机分配到四个组之一:对照组饮食中含100%赖氨酸(CON+L100;n=8)、对照组饮食中含70%赖氨酸(CON+L70;n=8)、CUMS组饮食中含100%赖氨酸(CUMS+L100;n=9)以及CUMS组饮食中含70%赖氨酸(CUMS+L70;n=9)(图6A)。 在经历了4周的应激和饮食赖氨酸限制后,CUMS+L70组在糖水偏好测试(SPT)中的糖水偏好度显著偏低(图6B)。随后,对四组大鼠的前额叶皮质(PFC)进行了mRNA测序,以探究潜在的分子机制。在CUMS+L70与CUMS+L100的比较中,共鉴定出1428个差异表达基因(图6C)。为了进一步阐明DEGs的模式,对PFC进行了四次比较的KEGG富集分析。在鉴定的途径中,有九条与神经系统相关(图6D)。在CUMS+L70组与CUMS+L100组相比,在mRNA和蛋白水平(图6E)上均观察到EAAT3(slc1a1)和EAAT2(slc1a2)表达下调。此外,通过qRT-PCR和Westernblot分析显示,在FMT_MDD组中,PFC中EAAT3(slc1a1)和EAAT2(slc1a2)的表达显著下调。这些发现表明,饮食中赖氨酸的缺乏可能通过降低PFC中EAATs的表达,增加青少年大鼠对抑郁症的易感性。 图6 饮食中赖氨酸的限制可能通过调节前额叶皮质(PFC)中的兴奋性氨基酸转运蛋白(EAATs),增加青少年大鼠慢性不可预见性温和应激(CUMS)模型对抑郁的易感性。 作者的多组学研究揭示了患有抑郁症的儿童和青少年的血浆代谢物、肠道微生物群和大脑功能连接发生了深刻而复杂的改变。肠道微生物可能通过氨基酸缺乏的微生物群-肠-脑(MGB)轴起作用,通过降低前额叶皮质(PFC)中兴奋性氨基酸转运蛋白(EAATs)的表达,影响儿童和青少年的抑郁症状。此外,作者的研究结果表明,在赖氨酸缺乏条件下,青少年大鼠对抑郁的易感性增加,这也与PFC中EAATs表达的降低有关。作者对患者的多组学分析以及对大鼠的体内实验结果,有助于作者理解MGB轴与儿童和青少年抑郁症之间的因果关系。 参考文献 Teng T, Huang F, Xu M et al. Microbiota alterations leading to amino acid deficiency contribute to depression in children and adolescents. Microbiome. 2025 May 19;13(1):128. doi: 10.1186/s40168-025-02122-w.