
摘 要
癌症的发病率在过去几十年中大幅增加,给癌症治疗带来了严峻的挑战。以免疫检查点抑制剂(ICIs)为代表的抗肿瘤免疫疗法,在不受癌症类型限制的广泛范围内具有良好的缓解效果。然而,其疗效在不断积累的研究中似乎存在异质性。新近的证据表明,肠道微生物组可以调节抗肿瘤免疫反应并预测临床预后。因此,通过粪便微生物移植(FMT)重塑微生物组特征,可能能够通过调节免疫-肿瘤细胞相互作用和改变微生物代谢物,从而微妙地改变肿瘤微环境,增强宿主ICIs的表现。在这篇综述中,作者综述当前支持FMT在增强抗肿瘤免疫反应和减轻肿瘤相关并发症方面的有效性的实验和临床证据。此外,作者还讨论了FMT面临的挑战,并提出了可行的解决方案,这些方案可能为未来的临床操作提供重要的指导。
引 言
在全球范围内,癌症已经演变成为一个重大的公共卫生问题,进一步加剧了沉重而不断增加的社会和经济负担。在过去的几十年里,肿瘤的发展、进展和转移的机制已经逐步揭示,它们构成了宿主免疫状态和外部环境之间的复杂网络。干扰免疫逃逸的下游和T细胞激活的共抑制信号,已经在抗肿瘤免疫疗法中显示出显著的效果。阻断免疫检查点途径是建立抗肿瘤免疫的最常见方法之一,癌细胞可以通过免疫检查点途径伪装成人体的正常组成部分。随着免疫阻断疗法的深入研究,免疫检查点抑制剂(ICIs)逐渐走到了前沿,并获得了积极的临床证据。值得注意的是,ICIs的治疗效果似乎与宿主的微生物组环境有关。
在宿主生物中,由数万亿个共生微生物组成的肠道微生物组常被整体描述为一个“超级器官”。肠道微生物群落在众多因素中,通过其代谢产物维持着抑制-促进肿瘤发生的微妙平衡。以前的研究强调,微生物的变化,以病原体数量的显著增加和有益细菌的相对减少为特征,与胃肠道和胃肠道外癌症的发展有关。有一个公认的说法,肠道微生物组在调节宿主免疫调节、维持癌症免疫稳态和维持肿瘤微环境(TME)方面发挥着独特的作用。一些细菌通过激活免疫力来帮助对抗肿瘤,而另一些细菌则通过介导免疫抑制来帮助癌细胞逃避免疫监视。研究报告称,肠道微生物组与抗肿瘤免疫因子有关,因为共生细菌拟杆菌门(Bacteroidetes)与抗肿瘤免疫因子呈正相关,而致病性亚群变形菌门(Proteobacteria)则呈负相关。 此外,有力的证据表明,调节肠道微生物组可以增强癌症治疗的效果,特别是免疫疗法。因此,通过改变微生物组合来调节对抗肿瘤免疫疗法的免疫反应,具有极大的可行性和光明的前景。在这种情况下,FMT作为一种整体操纵肠道微生物组的干预手段,显示出了有希望的前景。这种调节肠道微生物组的工具在恢复健康功能的肠道微生物组方面具有很大的优势,特别是在常规的抗生素治疗扰乱了正常的肠道微生物平衡之后。由于无效比例和潜在风险的存在,FMT的应用需要在施用前对捐赠者和受体进行谨慎的筛选。
本综述旨在共同强调肠道微生物组和抗肿瘤免疫疗法之间的复杂关联,以及FMT在提高治疗效果方面的临床应用。我们将概述FMT在促进特定组织病理学肿瘤类型的抗肿瘤免疫反应方面的应用,并最后讨论其当前面临的挑战和前景的利弊。
正文
免疫检查点抑制剂(ICIs)在抗肿瘤临床中的应用
肿瘤免疫疗法在过去几十年中有了显著的发展。参与肿瘤发生免疫过程的免疫学检查点分子作为T细胞激活的共抑制受体,为其抗体的应用铺平了道路,这些抗体通常被称为ICIs,用于抗肿瘤治疗。在这些检查点中,程序性细胞死亡1(PD-1)及其配体PD-L1,以及细胞毒性T淋巴细胞相关抗原-4(CTLA-4),在维持T细胞激活和耐受方面发挥着决定性的作用。PD-1在激活的T细胞、B细胞、自然杀伤(NK)细胞和髓样细胞上表达。一旦PD-1与其配体相互作用,它就会降低免疫反应。肿瘤细胞能够激活CTLA-4,它通过与CD80/86配体竞争性结合来产生抑制性信号,从而使激活的T细胞沉默,同时调节CD4+辅助T细胞的激活,促进Tregs的增殖(图1)。PD-1和CTLA-4,以及其他负性免疫调节分子,如淋巴细胞激活基因3(LAG-3)、T细胞免疫球蛋白和粘蛋白含量分子3(TIM-3)、T细胞免疫球蛋白和ITIM结构域(TIGIT)和V结构域免疫球蛋白T细胞激活抑制剂(VISTA),产生了肿瘤进展的免疫抑制表型。因此,通过阻断PD-1/PD-L1和CTLA-4,ICIs为重新激活免疫细胞的功能和恢复免疫细胞的抗肿瘤活性提供了新的靶点。
图1免疫检查点抑制剂介导负性共刺激并调节肿瘤抗原,以抑制T细胞的激活和分化
ICIs由于在多种转移性肿瘤类型中具有广泛的生物活性,逐渐被视为免疫疗法中的先驱和领导者,其中以转移性黑色素瘤和非小细胞肺癌(NSCLC)为代表。然而,即使在这些肿瘤中,ICIs的效果有时也会令人遗憾地不理想。尽管ICIs的应用取得了实质性的进展,但癌症患者之间存在异质性的效率。一些癌症患者对ICIs有抵抗性或者只显示短暂的反应,同时可能发生多种并发症,因此ICIs应用的安全性难以保证。延长暴露时间和增加给药剂量可能改善免疫反应,但同时伴随着免疫相关不良事件(irAEs)的发生频率增高。目前已经提出了多种与ICIs无反应相关的机制,包括低突变负荷、抗原呈递能力差、肿瘤抗原负荷低、免疫检查点独立的免疫抑制和肿瘤特异性T细胞耗竭。积累的研究表明,这种异质性的产生可能与肠道微生物组有关。
肠道微生物组调节在抗肿瘤免疫疗法中的作用
在过去的几十年里,肠道菌群失衡被报道与自身免疫性疾病和肿瘤发生有流行病学上的关联。肠道菌群失衡通过几种途径导致肿瘤发生:宿主基因组的转化,损害DNA稳定性的毒力因子,代谢失调,不适当的免疫系统启动和屏障损伤。与此同时,随着RNA和DNA测序、代谢功能分析、细菌鉴定和培养技术以及专门的动物模型的快速发展,人们越来越清楚地认识到肠道微生物群对肿瘤发展和肿瘤免疫反应都有影响。大量的研究通过粪便样本的分析,证明了特定的微生物组在肿瘤进展和抗肿瘤过程中具有代表性。幽门螺杆菌(Helicobacter pylori)被广泛认为与胃癌相关。大肠杆菌(Escherichia coli),拟杆菌属(Bacteroides fragilis)或梭杆菌属( Fusobacterium nucleatum)被认为与结肠肿瘤相关。链球菌属(Streptococcus bovis)可能通过招募CD11b⁺TLR-4⁺细胞,诱导一种有利于结直肠癌的抑制性免疫。
除了肿瘤发展外,微生物组也被报道影响抗肿瘤免疫疗法的反应。通过使用16S rRNA基因筛选、宏基因组散弹枪测序和无偏倚的代谢组分析,研究者鉴定了具有不同ICIs反应的肿瘤患者的肠道微生物组。值得注意的是,在不同的癌症类型中,已经证明了某些细菌物种与ICIs反应之间的关联,表明存在“应答者”和“非应答者”肠道微生物组轮廓。我们总结了与癌症患者更好的ICIs临床效益相关的肠道微生物组的特征(表1)。在不同的微生物组组成中,粘液阿克曼氏菌(Akkermansia muciniphila)被发现是唯一在黑色素瘤、NSCLC和RCC的队列中一致的基于微生物组的标志。一些混杂因素可能导致这种共识的缺乏,如收集和DNA提取方案、样本量不足、研究时间短、遗传和地理的偏差、饮食和用药差异等,因此应答者和非应答者的微生物标志在功能上相关,但是固有于每个队列。尽管如此,宿主微生物组标志显示了其在预测预后以及调节免疫疗法反应效力方面的潜力。进一步的研究应该在更大的队列中评估有利的肠道微生物组特征的最佳配方,并标准化研究方法,以便于临床试验之间的比较。
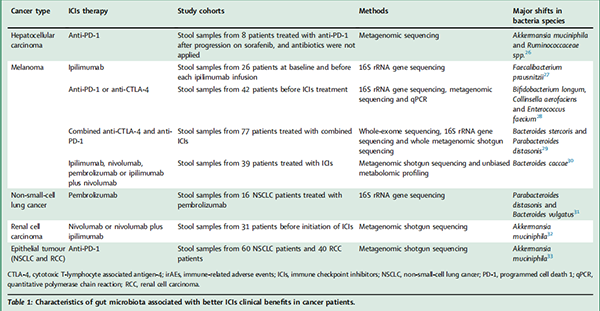
表1与癌症患者更好的ICIs临床益处相关的肠道微生物群特征
稳定和功能性的共生微生物群落受到了极大的重视,随后,修复肠道微生物组以减轻肿瘤进展引起了广泛的关注。饮食控制是一种改变策略之一,因为生酮饮食诱导了依赖T细胞的肿瘤生长延迟,在侵袭性肿瘤模型中表现出效果。补充特定的细菌可能产生积极的效果。肠球菌(Enterococcus)调节了小鼠模型中对抗PD-1抗肿瘤免疫疗法的反应。下一代益生菌(NGPs),即普氏粪杆菌(Faecalibacterium prausnitzii)和脆弱拟杆菌(B. fragilis)作为生物活性药物,受到了越来越多的关注。值得注意的是,无毒素的脆弱拟杆菌(B. fragilis)可以抑制艰难梭菌和海德堡沙门氏菌的生长或转位,从而获得竞争性保护,因此具有类似益生菌的特性。遗憾的是,目前还没有共识,特定的菌株是否可以增强抗肿瘤免疫疗法的效果。一个可能的原因是,补充单一的益生菌会破坏肠道微生物组作为一个平衡整体的多样性。同时,人类肠道微生物组的复杂性使得难以鉴定特定的物种,更不用说稳定培养有利的菌株了。此外,益生菌菌株可能引起的细菌血症的不良影响可能超过它们的潜在益处。这一主要的限制促使研究者将肠道微生物组作为一个整体进行移植,其中FMT最受关注。
FMT可以通过微生物及其活性产物调节肠道微生物平衡和免疫平衡,以治疗疾病。这种前沿的技术进步在艰难梭菌感染(CDI)中显示出安全的疗效。目前,许多临床试验正在进行中,以确定FMT在多种癌症性疾病中的有效性。FMT直接塑造肠道微生物组,并选择性地改变微生物的组成和丰度,从而间接影响ICIs。FMT辅助抗肿瘤免疫疗法一直引人注目,目前有几项临床试验正在进行中(表2)。通过将健康和平衡的微生物群落作为一个整体移植到一个不平衡的生态系统中,FMT可能重新建立肠道的微生物平衡和整个身体的稳态。FMT治疗主要通过提高异质性反应率、逆转ICI免疫疗法的抵抗性和削弱潜在的irAEs,发挥其增强免疫力的效果,同时具有减少频繁干预的需求的显著优势。两项在转移性黑色素瘤患者中进行的里程碑式的FMT临床试验证明了FMT在增强抗PD-1反应方面的有效性和安全性,说明了它在抗肿瘤联合治疗中的巨大应用前景。这些结果证实了FMT在重新诱导抗PD-1治疗方面的有效性和安全性,并共同支持了通过调节肠道微生物组来增强肿瘤免疫疗法的概念。


表2粪便菌群移植(FMT)在免疫检查点阻断治疗中的临床研究
FMT增强肿瘤免疫治疗疗效的机制
FMT长期调节肠道微生物群
通过抗生素改变肠道微生物组的多样性和组成,对NSCLC或RCC患者的抗PD-1反应产生负面影响,这表明微生物组是调节免疫疗法效果的关键因素。 FMT显著增加了肿瘤携带者的肠道微生物组群落的多样性。它是通过转移整个供体微生物生态系统来调节肠道微生物组的最直接的方法,它比单一的假定细菌更有可能建立生态平衡。因此,FMT有望增加对免疫疗法有抵抗性的癌症患者的肠道微生物群落的多样性和组成。此外,这种扰动似乎是持续的力量。Davar等人对黑色素瘤患者进行了长期观察,这些患者在FMT后对抗PD-1治疗有反应或无反应,并通过宏基因组散弹枪测序评估了FMT前后的微生物组特征。所有FMT后的粪便中的微生物组都比FMT前的粪便在长期内表现出更高的α多样性,而且在反应接受者(Rs)与非反应接受者(NRs)之间的差异更为显著。
微生物代谢物介导对ICIs的抗肿瘤反应
值得注意的是,肠道微生物组合成和转化的多种代谢物,可以通过FMT转化,然后扩散并影响免疫疗法中的抗肿瘤免疫反应。肠道伪长双歧杆菌(Bifidobacterium pseudolongum)衍生的代谢物肌苷转位并刺激T细胞特异性腺苷A2A受体(A2AR),在外源性干扰素-γ(IFN-γ)的存在下促进Th1细胞的分化,从而在抗CTLA-4和抗PD-L1治疗期间产生全身效应。短链脂肪酸(SCFAs)被发现可以促进CD8+ T细胞的抗肿瘤细胞毒性,并为免疫细胞提供能量。结合最近的研究表明,SCFAs促进CD8+ T细胞作为记忆细胞的长期存活,普氏粪杆菌(Faecalibacterium prausnitzii)可能通过增加SCFAs介导的CD8+ T细胞的记忆潜能,增强抗肿瘤免疫反应。这些研究共同证明,FMT可能通过改变微生物组和肿瘤代谢,恢复抗肿瘤的表现。
FMT调节了肠道微生物组介导的抗肿瘤免疫反应
微生物组分析表明,肠道微生物组组成与TME中的肿瘤浸润免疫细胞有关,这会调节免疫疗法的效果。多项研究已经发现了一些特定的细菌物种,如粘液阿克曼氏菌(A. muciniphila),粪杆菌属(Faecalibacterium),瘤胃菌科(Ruminococcaceae), 短双歧杆菌(Bifidobacterium breve),青春双歧杆菌(Bifidobacterium adolescentis),长双歧杆菌(Bifidobacterium longum),Collinsella aerofaciens和粪肠球菌(Enterococcus faecium),在系统和TME中,它们被发现通过增加抗原呈递和改善效应T细胞功能促进抗PD-1免疫疗法的效果(图2)。相反,拟杆菌目(Bacteroidales)的丰度较高,表现出更高水平的Treg细胞和髓源性抑制细胞(MDSCs),限制了肿瘤内淋巴细胞的浸润,并削弱了抗原呈递的能力,导致NRs的预后不佳。值得注意的是,FMT治疗在临床免疫疗法难治性黑色素瘤模型中也显示出了有希望的结果,这与肠道固有层的免疫细胞浸润和基因表达的有利变化,以及CD8+ T细胞、DC激活和增强的IFN-γ信号在TME中的增加有关。
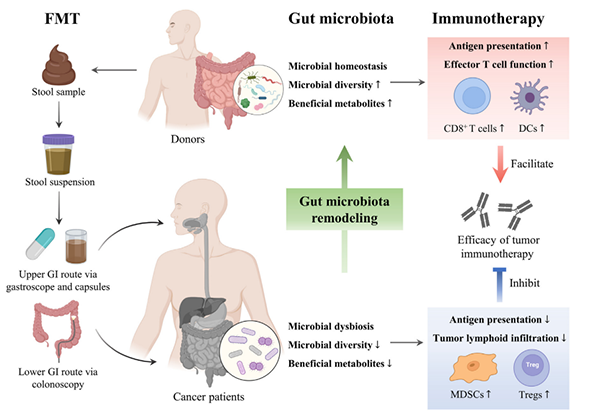
图2:粪便微生物群移植通过改变肠道微生物群来增强抗肿瘤免疫反应
这些临床观察结果得到了来自无菌或抗生素处理的小鼠的患者来源的FMT的进一步证实。接受Rs粪便的小鼠显示出改善的抗PD-L1反应,但来自非反应患者的FMT失败了。从机制上讲,接受Rs来源的FMT的小鼠具有富集的效应细胞,如CD8+ T细胞和CD45+CD11b+Ly6G+细胞,以及减少的抑制性CD11b+CD11c+髓样细胞。接受NRs来源的FMT的小鼠具有更高的调节性RORγT+ T辅助17细胞,CD4+FoxP3+和CD4+IL-17+ T细胞的频率,提示宿主免疫反应受损。同样,另一项研究表明,NRs来源的FMT在小鼠中对PD-1阻断具有抵抗性,而粘液阿克曼氏菌(A.muciniphila)的相对丰度显著降低。通过增加CCR9+CXCR3+CD4+ T淋巴细胞在TME中的招募,促进IFN-γ的释放,并诱导DCs分泌IL-12,一种参与PD-1阻断的免疫原性的Th1细胞因子,可以用粘液阿克曼氏菌恢复PD-1阻断的效果。此外,拟杆菌属(B. fragilis),多形拟杆菌(Bacteroides thetaiotaomicron)和伯克霍尔德菌属(Burkholderia)的相对丰度的显著变化,被发现通过增强肿瘤引流淋巴结中的IL-12依赖性Th1免疫反应,并促进肿瘤内DCs的成熟,来增强CTLA-4阻断对小鼠肿瘤生长的抑制作用。肠道共生双歧杆菌(Bifidobacterium)可以增强DCs的功能,改善CD8+ T细胞,从而促进抗PD-L1的效果。令人惊讶的是,口服双歧杆菌被发现具有在TME中积累并通过DCs中的干扰素基因刺激物(STING)信号通路促进局部抗CD47免疫疗法的能力,这增加了I型IFN,激活CD8+ T依赖性的抗肿瘤免疫。
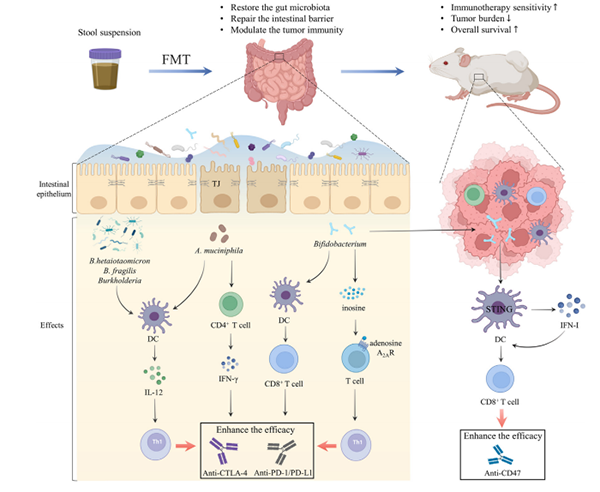
图3粪便微生物群移植重塑了肿瘤微环境,从而提高了癌症免疫治疗的疗效
FMT是一种有前途的临床治疗,促进抗肿瘤免疫治疗策略
FMT治疗消化系统肿瘤——
结肠直肠癌
基于ICIs的免疫疗法已经证明是一种治疗多种癌症的选择,但是只有少数的结直肠癌(CRC)患者获得了明确的治疗效益。一项最近的研究发现,与接受健康对照者粪便的小鼠相比,接受CRC患者粪便的小鼠的抗PD-1单克隆抗体的效力大大降低。在FMT联合治疗中,观察到产丁酸菌的上调,T细胞的浸润和激活增加。另一项研究报告,FMT联合抗PD-1在携带结直肠肿瘤的小鼠中显示出与单独接受抗PD-1的小鼠相比的协同效应,这可能归因于包括石榴油酸在内的代谢物的上调。几项临床试验精确地测量了ICIs联合FMT治疗的客观反应率(ORR),从而为潜在的协同联合治疗制定了蓝图。
胰腺癌
在胰腺癌中,肠道微生物组的组成发生了变化,这在患者和小鼠模型中都有观察到。与健康人相比,胰腺癌患者具有更多的马拉色菌属(Malassezia spp.)、铜绿假单胞菌(Pseudomonas aeruginosa)、梭杆菌属(Fusobacterium spp.),以及更少的产丁酸菌和乳杆菌(Lactobacillus)。微生物组的消除可能通过减少髓源性抑制细胞和增加M1巨噬细胞的分化,促进CD4+ T细胞的Th1分化和CD8+ T细胞的激活,来保护机体免受胰腺导管腺癌的侵害。微生物组的消除还通过上调PD-1的表达,增强了ICIs的效果。美国正在进行的一项临床试验在胰腺癌患者中实施了FMT,以评估FMT在可切除的胰腺导管腺癌患者中的安全性、耐受性和可行性(NCT04975217)。
FMT治疗消化系统以外的肿瘤——
黑素瘤
在过去的几年里,ICIs免疫治疗在晚期黑色素瘤患者中得到了广泛的应用,并显著提高了患者的一般生存率。目前应用于黑色素瘤免疫治疗的ICIs包括抗CTLA-4单克隆抗体(伊匹单抗和特雷姆单抗)、抗pd-1药物(尼鲁单抗、派姆单抗和兰溴珠单抗)、BRAF和MEK抑制剂(达非尼加、曲美替尼、维美替尼、恩可非尼、加比尼、比尼替尼),其中绝大多数显示积极促进抗肿瘤疗效。然而,对免疫治疗反应的异质性仍然存在,这种差异可能是由于不同的肠道微生物群和代谢物组成造成的。
在临床前研究中,已经证明某些肠道微生物组可以促进黑色素瘤小鼠的肿瘤负担缓解。进一步的临床研究关注黑色素瘤患者之间的肠道微生物组差异。粪拟杆菌属(Bacteroides caccae)在所有类型的ICIs,包括伊匹单抗、尼鲁单抗和派姆单抗中,都富集在反映组(Rs)中,以及更高水平的石榴油酸。在一项前瞻性研究中,对来自澳大利亚和荷兰的103名接受新辅助ICIs治疗的转移性黑色素瘤患者进行了分析,研究人员观察到富含瘤胃球菌类微生物组的应答率高于拟杆菌科主导的微生物组。值得注意的是,这种微生物特征可能受到外部干扰(饮食、生活方式和地理)的影响。在另一项研究中,研究者发现普通拟杆菌(Bacteroides vulgatus)和多氏拟杆菌(Bacteroides dorei)能够预测接受伊匹单抗和尼鲁单抗治疗的晚期黑色素瘤患者的免疫相关不良反应。然而,对整个宿主肠道微生物组的操作仍处于临床前阶段。
两项同时发表在《科学》杂志上的临床试验补充了临床前模型的结果,并首次证明了通过FMT改变整个肠道微生物组可以纠正难治性癌症患者的免疫疗法抵抗性的概念证明。在第一阶段的试验(NCT03353402)中,研究人员对10名抗pd-1难治性转移性黑色素瘤患者进行了治疗,他们在接受尼鲁单抗单药治疗后获得完全应答(CR),并评估了尼鲁单抗再诱导的安全性和可行性。三名接受者获得了六个月的无进展生存,其中两名部分反应(PR)和一名临床缓解(CR)。然后,研究者在微生物组分析和活检方面进一步深入。总体而言,所有FMT接受者的肠道微生物组组成发生了变化;缓解组(Rs)具有明显扩张的免疫疗法有利特征,具有更高的肠球菌科(Enterococcaceae)、肠球菌(Enterococcus)和澳大利亚链球菌(Streptococcus australis)的相对丰度,以及更低的非典型威氏菌(Veillonella atypica)的相对丰度。在肠道固有层和TME中,观察到免疫细胞浸润和基因表达谱的有利变化。
在另一项同时进行的二期临床试验(NCT03341143)中,招募了对单独使用抗PD-1或联合使用抗CTLA-4或试验性药物有抵抗性的患者,给予来自单一供体的FMT,并与pembrolizumab联合内镜下给药。供体是转移性黑色素瘤患者,在接受(nivolumab或pembrolizumab)治疗后,持续PR或CR。与前一项研究不同的是,只有符合原发性ICIs抵抗性(无先前反应和确诊进展性疾病)标准的患者才有资格参加。结果表明,15名患者中有6名获得了临床效益,包括1名CR,2名PR,以及3名呈现稳定疾病(SD)超过一年的接受者。同样,FMT成功地将肠道微生物组重新定向为有利于抗PD-1反应的组成。在FMT后的应答者中,厚壁菌门(Lachnospiraceae和Ruminococcaceae科)和放线菌门(Bifidobacteriaceae和Criobacteriaceae科)显示出显著的富集,而拟杆菌门则减少。此外,应答者的宿主免疫反应和代谢也发生了调节,如前所述,增强了外周血中粘膜相关不变细胞和外周和TME中CD8+ T细胞的激活,从而抵消了髓样细胞诱导的免疫抑制。
最终,这两项重大的临床突破共同证实了 FMT 结合 PD-1 阻断策略可以改善肠道菌群和重编程肿瘤微环境,以逆转对抗 PD-1 治疗的耐药性,治疗难治性黑色素瘤。值得注意的是,两项研究都强调了厚壁菌门 与 ICIs 临床反应效果之间的关联;然而,宿主分类群与临床反应之间的关系存在争议。在一项最近的研究中,研究人员分析了 316 例 FMT 的宏基因组,这些 FMT 是在治疗十种不同疾病指标的前后采样的。他们认为,接受者而不是供体决定了 FMT 后肠道菌群的“混合”状态。深入的研究没有发现任何菌株本质上比其他菌株更具侵袭性/抗逆性的强有力证据。相反,菌落结构和多样性,以及供体-接受者菌落互补性决定了 FMT 后肠道菌群的恢复力、共存和定殖。在另一项综合的宏基因组学系统性荟萃分析中,报道了供体菌株移植率较高的患者更有可能在 FMT 后获得临床成功。有力的随机对照试验有必要更清楚地勾勒出这种联系。
非小细胞肺癌
许多先前的证据为缺乏敏感性 EGFR 或 ALK 突变的转移性 NSCLC 中抗 PD-1/PD-L1 发挥作用奠定了基础。但是,反应率仍然低于 25%。肠道菌群在抗肿瘤反应的广泛研究中激发了极大的热情。最近的研究发现,NSCLC 患者中 Prevotella、Gemmiger 和 Roseburia 的丰度升高。从 NSCLC 患者身上提取的菌群进行的 FMT 导致小鼠肠道炎症和免疫紊乱。在另一项研究中,黄等人招募了 16 名 NSCLC 患者,并观察到 pembrolizumab Rs 和 NRs 表现出不同的肠道菌群多样性,其中 Parabacteroides distasonis 和 B. vulgatus 的丰度有差异。研究人员然后诱导共同的人参多糖、FMT 和 αPD-1 单克隆抗体(mAb)来重塑肠道菌群组成,并将它们视为新型益生元,以增强 NSCLC 患者对抗 PD-1 免疫治疗的反应。有趣的是,这项研究可以提供一个额外的有价值的见解,即肠道菌群特征,如 alpha 多样性或更具体的物种可以作为预测 ICIs 效果的生物标志物。
肾细胞癌
ICIs 对 RCC 的引入,给临床结果带来了革命性的转变,但是异质性的反应仍然不能满足稳定的医疗需求。大量的证据揭示了肠道菌群在 RCC 发展和患者预后中的作用。 在一项 II 期试验(NCT03013335)中,招募了 69 名接受 nivolumab 治疗的 RCC 患者。根据他们的结果,近期使用抗生素使 nivolumab 的反应率从 28% 降至 9%,但显著增强了 Clostritidium hathewayi 的优势。这种菌群组成的改变也在与健康供体相比的 RCC 患者中观察到。来自 Rs 的 RCC 载体小鼠的 FMT 的平行临床前研究显示,耐药组表现出补偿性的反应。在有益共生菌(A. muciniphila 和 Bacteroides salyersiae)移植中也观察到了类似的补偿,从而建立了肠道菌群和 ICIs 临床效果之间的因果关系。
FMT增强了抗肿瘤免疫治疗的疗效:问题和希望
FMT 成功的决定因素非常复杂。有几种选择可以考虑促进移植物的植入和减少伴随的副作用。首先,对供体和受体进行有利的筛查评估是至关重要的,这包括影像学、肿瘤活检和血清学/粪便检查,以确认 FMT 给药的适应性。为了防止 FMT 期间传播致病微生物,应注意对供体进行筛查:筛查血液和粪便,在 FMT 前对粪便样本进行病毒 PCR,建立供体的随访系统并进行定期检查。例如,在 COVID-19 大流行期间,所有的粪便样本都通过 RT-PCR 进行了测序,以防止它在 FMT 期间传播。其次,供体-受体的互补性决定了 FMT 后肠道菌群的恢复力、共存和定殖。菌群稳定性和物种均匀度被证实是与治疗反应相关的新指标。因此,需要仔细选择合适的供体-受体匹配,以实现目标治疗。第三,个体的身体状况。鉴于越来越多地意识到操纵菌群作为癌症治疗的协同疗法,对于相同的结果是否适用于癌症患者或非癌症携带者的担忧不可低估。正如前面提到的,ICIs 的效力需要特定的炎症诱导的 TME。因此,对于癌症患者和非癌症个体而言,期望的临床调节菌群的工具可能有所不同。需要更多的扎实的研究和精确的表征,以确定有利或不利的菌群操纵对象是什么。最后但并非最不重要的是,必须仔细评估 FMT 的给药途径,以进一步保护治疗性肠道菌群并实现最佳效果。传统的给药途径包括灌肠、内镜或鼻肠管,而最近的口服胶囊的应用显示了在 FMT 制剂方面的限制较少、无创和更容易接受的优势。强烈推荐上消化道给药、下消化道给药或胶囊化 FMT 的单一途径,而决定因素是病变部位和 FMT 剂量。当接受多途径 FMT 时,观察到移植物的植入增加。顺序组合的 FMT 途径也应用于几个临床试验(例如 NCT04729322、NCT03353402 和 NCT04758507),这可能会产生直接和无创的给药。然而,在考虑 FMT 成功和患者临床效果的决定因素时,仍缺乏足够的临床试验。需要更多的大规模队列和 FMT 结合肿瘤免疫治疗的机制研究,以实现精准和个性化的肿瘤管理。
结论和展望
以 ICIs 为代表的肿瘤免疫治疗在过去几年中受到了越来越多的关注,肠道菌群被证实在调节抗肿瘤治疗效果中起着至关重要的作用。FMT 作为一种整体性的操作,被提出作为一种理想的联合协同治疗,以提高 ICIs 的效果并消除异质性的结果。通过重塑肠道菌群,平衡菌群代谢物和重塑肿瘤微环境,FMT 作为一种辅助剂,与 ICIs 合作,提高抗肿瘤免疫反应。然而,在 FMT 的有效性和其长期后果方面仍存在多个探索空白。虽然已经取得了很多进展,但仍有许多问题尚未得到解答。例如,如何最大化抗生素使用的好处?操作 FMT 的最佳策略是什么?接受 ICIs 的患者改善临床结果的最佳菌群是什么?联合治疗的优化、FMT 给药的适当途径、转化前的供体筛查和整个过程中的受体监测的加强,可能会在一定程度上帮助降低风险。综上所述,FMT 提供了一种更有效和安全的微生物治疗线索,以协同抗肿瘤免疫治疗。我们寻求对“友好菌群”及其对抗肿瘤免疫反应的潜在功能的更深入的研究,以优化不受限制的肿瘤类型之间的免疫治疗效果。
本文译自:Yang Yi, An Y, D Y, et al. Fecal microbiota transplantation: no longer cinderella in tumour immunotherapy. EBioMedicine. 2024 Feb, doi: 10.1016/ j.ebiom.2024.104967
发表杂志:EBioMedicine
影响因子:11.0
通讯作者:Hailong Cao
作者单位:Tianjing Medical University.